
【题目】将一小块钠投入盛10mL饱和澄清石灰水的烧杯中,不可能观察到的现象是
A. 钠熔成小球并在液面上游动 B. 有气体生成
C. 溶液底部有银白色金属物质生成 D. 溶液变浑浊
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化,试回答:

(1)写出B的化学式_______________,D的化学式_______________________。
(2)写出由B转变成E的化学方程式_____________________________。
(3)写出用KSCN鉴别G溶液的离子方程式______________;向G溶液加入A的有关离子反应方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
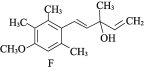
【题目】有机物F是合成药物“银屑灵”的中间体,其合成流程如下:
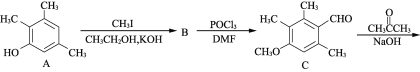
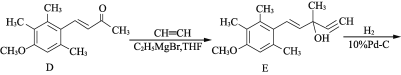
(1) 化合物C中含氧官能团的名称为________、________。
(2) D→E的反应类型为________________,C→D经历了先加成再消去的反应过程,请写出中间产物的结构简式:___________________________。
(3) 化合物B的分子式为C10H14O,写出B的结构简式:________________。
(4) 写出同时满足下列条件的C的一种同分异构体的结构简式:____________________。
①不能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
(5) 已知: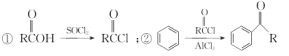 以苯甲醇、乙醛为原料制备
以苯甲醇、乙醛为原料制备![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________________ 。
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭真空容器中,反应2BaO2(s) ![]() 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A. 平衡常数减小 B. BaO量不变 C. 氧气压强不变 D. BaO2量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,向0.1mol·L-1的醋酸溶液中加水稀释,溶液中c(H+)/c(CH3COOH)增大
B. 反应N2(g)+3H2(g) ![]() 2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
2NH3(g) (△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动
C. 镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
D. 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,二氧化氮和四氧化二氮之间存在下列平衡2NO2(g)![]() N2O4(g)(放热反应)在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是( )
N2O4(g)(放热反应)在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是( )
A. 温度130℃,压强3.03×105PaB. 温度25℃,压强1.01×105Pa
C. 温度130℃,压强5.05×104PaD. 温度0℃,压强5.05×104Pa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应 3A(g)+2B(g)![]() zC(g)+2D(g)。在2L的密闭容器中把4molA和2molB混合,2min后反应达到平衡时生成1.6 mol C,又测得D的反应速率v(D)= 0.2 mol.L-1min-1。则下列说法不正确的是( )
zC(g)+2D(g)。在2L的密闭容器中把4molA和2molB混合,2min后反应达到平衡时生成1.6 mol C,又测得D的反应速率v(D)= 0.2 mol.L-1min-1。则下列说法不正确的是( )
A. z=4B. B的转化率是40%
C. A的平衡浓度是1.4mol.L-1D. 平衡时气体压强是原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:
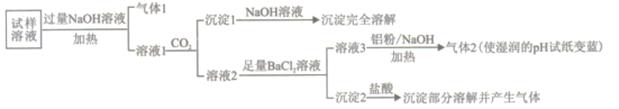
已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3![]() 气体2”的离子方程式为_________。
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
根据实验结果可判断该地区大气颗粒物污染主体有___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com