
����Ŀ���ں��º�ѹ�£����ܱ������г���4mol A��2 mol B���������·�Ӧ��2A(g)+B(g)![]() 2C(g)��H��0��2min��Ӧ�ﵽƽ�⣬����CΪ1.6mol�������з�����ȷ���ǣ���
2C(g)��H��0��2min��Ӧ�ﵽƽ�⣬����CΪ1.6mol�������з�����ȷ���ǣ���
A. ����Ӧ��ʼʱ�������Ϊ2L����Vc��0.4molL-1min-1
B. ���ں�ѹ���������·�Ӧ��ƽ���nc��1.6mol
C. ��2min������������Ͷ��2mol A��1 mol B�� B��ת���ʱ��
D. ���÷�Ӧ�ں��º����½��У��ų�����������
���𰸡�B
��������
A�����Ӧ�ں��º����£���Vc��n/Vt=1.6/2��2=0.4molL-1min-1��������Ϊ��ѹ�����ŷ�Ӧ�Ľ��У������С����Vc>0.4molL-1min-1����A�����
B���Ӧ���ȣ����ھ��������£���Ӧ���淴Ӧ������У���nc��1.6mol����B����ȷ��
C��ں��º�ѹ�£�����������Ͷ��2molA��1molB����ԭƽ��Ͷ�ϳɱ�����2:1�������Ը�ƽ����ԭƽ��Ϊ��Чƽ�⣬����B��ת���ʲ��䣬��C�����
D�����Ӧ�ں��º����£�ѹǿ��С��ƽ�������ƶ������ȼ��٣���D�����
��������������ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������dzµ��㡱������Ϊ���ڴ������������������ζ��������������ʵ�������ǿ�������ͼ��ʾ��װ������ȡ�������������ڸ�ʵ���˵������ȷ����
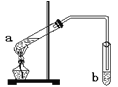
A. a�Թ��з����ķ�Ӧ��������Ӧ��ԭ����������ȥ�ǻ����Ҵ�����
B. b�Թ�����ʢ���Լ���NaOH
C. ��Ӧ��b�п��Կ������Եķֲ㣬�������ϲ�
D. �Թ�b�еĵ���Ҫ��Һ������Ϸ������ܲ���Һ�����£���Ϊ�˷�ֹ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�ڹ�������������Ҫ���塣�ش��������⣺
��1���ں��º�ѹ�����£���װ���з����ϳɰ��ķ�ӦN2(g)+3H2(g)![]() 2NH3(g) ������˵����ȷ������______��������ĸ��
2NH3(g) ������˵����ȷ������______��������ĸ��
A.����������ٱ仯�����Ѿ�ƽ��
B.�����ܶȲ��ٱ仯��������δ�ﵽƽ��
C.ƽ�����װ����ͨ�������ѹǿ���䣬ƽ�ⲻ�ƶ�
D.ƽ���ѹ������������ɸ���İ���
E.��������������������IJ���
��2��N2(g)+3H2(g)![]() 2NH3(g) ��H = ��92.0 kJ��mol��1������ʱ����ϵ�и�����Ũ����ʱ��仯������ͼ1��ʾ��
2NH3(g) ��H = ��92.0 kJ��mol��1������ʱ����ϵ�и�����Ũ����ʱ��仯������ͼ1��ʾ��
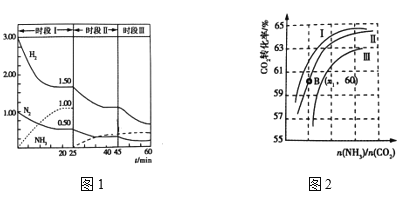
��25minʱ��ȡ�Ĵ�ʩ�� _______________________________ ��
������ʱ��ηֱ��Ǹı�һ�����������ƽ���ƶ���ƽ��ʱƽ�ⳣ��K����K����K���Ĵ�С��ϵ __________________��
����ʵ�ʹ�ҵ�����к͢��д�ʩ��Ŀ����ͬ��������ʩ���� _____________________��д������
��3���ٺϳɰ����������м价�ڲ�����CO�ᵼ�´����ж�������ͭҺ[���������ͭ����������ˮ]���գ�Cu(NH3)2Ac + CO + NH3 ![]() [Cu(NH3)3CO]Ac ��H<0����������CO��ͭҺ�����IJ������裨ע�����պ�������������__________________________________________________________________________
[Cu(NH3)3CO]Ac ��H<0����������CO��ͭҺ�����IJ������裨ע�����պ�������������__________________________________________________________________________
�����Ҫ���������Ӧ�ķ�Ӧ���ʣ�����߰�����ת���ʣ��ɲ�ȡ�Ĵ�ʩ����______��
a. ��ѹ b.�Ӵ��� c.���� d.��ʱ���߲���
��4�����ð�����ȡ����[CO(NH2)2]�ķ�ӦΪ��2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g) ��H<0����֪�÷�Ӧ��v (��)=k(��)c2(NH3)c(CO2)��v (��)=k(��)c(H2O)��k(��)��k(��)Ϊ���ʳ�������ƽ�ⳣ��K��k(��)��k(��)�Ĺ�ϵʽ��__________________
CO(NH2)2(l)+H2O(g) ��H<0����֪�÷�Ӧ��v (��)=k(��)c2(NH3)c(CO2)��v (��)=k(��)c(H2O)��k(��)��k(��)Ϊ���ʳ�������ƽ�ⳣ��K��k(��)��k(��)�Ĺ�ϵʽ��__________________
��ʵ�������У�ԭ��������ˮ������ͼ2��ʾCO2ת�����백̼��![]() ��ˮ̼��
��ˮ̼��![]() �ı仯��ϵ��
�ı仯��ϵ��
a. ��������Ӧ��ˮ̼��![]() ������_______________��
������_______________��
b.���B�㰱��ת����Ϊ40%����X1= _________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ�л�����ԭ�ϡ��������·�ش�
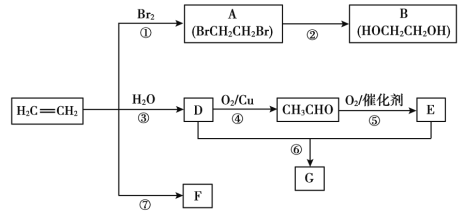
��֪��2CH3CHO + O2����������2CH3COOH
��1����Ӧ�ٵĻ�ѧ����ʽ��_______��
��2��B��������_______��
��3��F��һ�ָ߷��ӣ�����������ʳƷ������ṹ��ʽΪ_______��
��4��G��һ����״������ζ�����ʣ������������Ʒ���
�Ʒ�һ��ʵ������D��E��Ӧ��ȡG��װ����ͼ��ʾ��

i.��Ӧ�Ļ�ѧ����ʽ��______����Ӧ������_____��
ii.������Թ�������״Һ���õ�����Ҫ������_______��
�Ʒ�������ҵ����CH2=CH2��Eֱ�ӷ�Ӧ���G��
iii.��Ӧ������___��
iv.���Ʒ�һ��ȣ��Ʒ������ŵ���___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ã�����ҺA��μ������B�У����������в���ȷ����
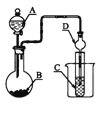
A. ��AΪŨ���ᣬBΪNa2SO3���壬C��ʢʯ����Һ����C����Һ�ȱ�����ɫ
B. ��AΪ������Һ��BΪ���ǣ�C��ʢ��������ʯ��ˮ����C����Һ�����
C. ��AΪŨ���ᣬBΪMnO2��C��ʢƷ����Һ����C����Һ����ɫ
D. ��AΪŨ��ˮ��BΪ��ʯ�ң�C��ʢAlCl3��Һ����C�в�����ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����Ҫ�Ļ���ԭ�ϣ������Ʊ�һϵ�����ʣ���ͼ��ʾ��������˵���������

A. ��ʽ������ˮ���ܲ���Fe��OH��3���壬��������ˮ��
B. Ϊ��ֹNH4HCO3�ֽ⣬����FeCO3���ڽϵ��¶��½���
C. ����KSCN��Һ���飨NH4��2Fe��SO4��2�Ƿ�����
D. �����£���NH4��2Fe��SO4��2��FeSO4������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪һ���¶��ºϳɰ���Ӧ��N2 +3 H2![]() 2 NH3 ��H=��92.4 kJ/ mol���ں��¡���ѹ���ܱ������н�������ʵ�飺��ͨ��1 mol N2��3 mol H2����ƽ��ʱ�ų�����ΪQ1����ͨ��2 mol N2��6 mol H2����ƽ��ʱ�ų�����ΪQ2�������й�ϵ��ȷ����( )
2 NH3 ��H=��92.4 kJ/ mol���ں��¡���ѹ���ܱ������н�������ʵ�飺��ͨ��1 mol N2��3 mol H2����ƽ��ʱ�ų�����ΪQ1����ͨ��2 mol N2��6 mol H2����ƽ��ʱ�ų�����ΪQ2�������й�ϵ��ȷ����( )
A. Q2 =2Q1=184.8kJ B. Q1 < 0.5 Q2 C. Q1 < Q2 < 184.8 kJ D. Q1 = Q2 < 92.4 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ұ���ķ���������Ϊԭ����ȡ��ϸ��-���������Ƚ��ͻ�����Ⱦ�ֿ��������Դ�������ʡ���֪���ҵ���Ҫ�ɷ�ΪAl2O3������������SiO2��FeO��Fe2O3�������Ʊ�ʵ���������£�
��1�������������������ᷴӦ�Ļ�ѧ����ʽΪ ��
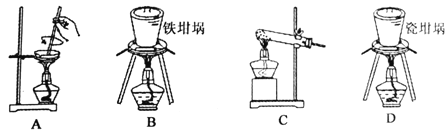
��2����ͼ������������NaOH�����Ʊ������ƣ��ɲ��õ�װ��Ϊ ����ѡ���ţ���
��3����ʵ�������У���30%��H2O2��Һ���������ӷ�Ӧ����ʽΪ ��
��4����֤������������Һ���Ƿ��������ӵIJ�������Ϊ ��
��5�����õ���pH��Һ������������õ�Fe(OH)3����֪��25��ʱ��Ksp[Fe(OH)3]=4.0��10-38������¶��·�ӦFe3++3H2O![]() Fe(OH)3+3H+��ƽ�ⳣ��Ϊ ��
Fe(OH)3+3H+��ƽ�ⳣ��Ϊ ��
��6������������茶��壬��������Ҫ��ӦΪ��4[NH4Al(SO4)2��12H2O]![]() 2Al2O3+ 2NH3��+ N2��+ 5SO3��+ 3SO2��+ 53H2O,������������ͨ����ͼ��ʾ��װ�á�
2Al2O3+ 2NH3��+ N2��+ 5SO3��+ 3SO2��+ 53H2O,������������ͨ����ͼ��ʾ��װ�á�
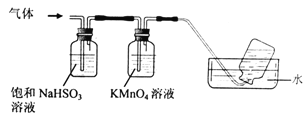
������ƿ���ռ����������� (�ѧʽ)��
��KMnO4��Һ��ɫ�����������ӷ�Ӧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ִ����Ӧ����㷺����Դ֮һ��
(1)ijԭ���װ����ͼ��ʾ��

���У�Zn�缫Ϊԭ��ص�______�������������������������缫��Ӧʽ��______��Cu�缫�Ϸ����ķ�Ӧ����______������������������ԭ���� ��Ӧ����ͭ��������4.48 L��������״����ʱ��������ͨ����______ mol���ӡ�
(2)���з�Ӧͨ��ԭ���װ�ã���ʵ�ֻ�ѧ��ֱ��ת��Ϊ���ܵ���______������ţ���
��CaO+H2O=Ca(OH)2
��2H2+O2 =2H2O
��2FeCl3+Cu=CuCl2+2FeCl2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com