
| A. | 由乙烯制取氯乙烷 | B. | 乙烷在空气中燃烧 | ||
| C. | 乙烷在光照下与氯气反应 | D. | 乙烯使酸性高锰酸钾溶液褪色 |
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| A. | 3:2:4 | B. | 1:1:1 | C. | 2:1:2 | D. | 1:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 10:1 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
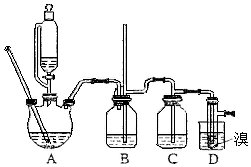 实验室制备1,2-二溴乙烷,用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:
实验室制备1,2-二溴乙烷,用16.0g的溴和足量的乙醇制备1,2-二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/0C | 78.5 | 132 | 34.6 |
| 熔点/0C | -130 | 9 | -116 |
| 溶解性 | 易溶水 | 难溶水 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2.在不同温度时K1、K2的值如表:
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2.在不同温度时K1、K2的值如表:| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,但NaClO强电解质 | |
| B. | HC1、SO2、HBr三种气体都可用浓硫酸干燥 | |
| C. | 向浓氨水中滴加FeCl3饱和溶液,可制得Fe(OH)3胶体 | |
| D. | SO2和SO3都是酸性氧化物,两者的水溶液都是二元强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1L物质的量浓度为2mol/L的(NH4)2S溶液中含有的S2-数目为0.2×6.02×1023 | |
| B. | 对NaCl溶液和金属钠加热,都会使导电能力增强 | |
| C. | 25℃时,向0.1mol/LCH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 | |
| D. | 用惰性电极电解1L 1mol/L的CuSO4溶液,当阴极析出3.2g铜时,加入0.05mol Cu(OH)2固体可将溶液浓度恢复至元浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 2mol CO2、6mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com