
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2.在不同温度时K1、K2的值如表:
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2.在不同温度时K1、K2的值如表:| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
分析 (1)①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
②反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2.
结合盖斯定律可知,①-②得到CO2(g)+H2(g)?CO(g)+H2O(g);
(2)①K为生成物浓度幂之积与反应物浓度幂之积的比,固体不能代入K的表达式中,结合平衡浓度计算K;
②能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大,可使平衡正向移动,但不能增加二氧化碳使平衡正向移动;
③结合平衡的特征“等、定”及衍生的物理量判定平衡状态.
解答 解:(1)①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
②反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2.
结合盖斯定律可知,①-②得到CO2(g)+H2(g)?CO(g)+H2O(g),
则△H=△H1-△H2、K=$\frac{{K}_{1}}{{K}_{2}}$,结合表格数据可知$\frac{1.47}{2.38}$<$\frac{2.15}{1.67}$,则升高温度K增大,即正反应为吸热反应,
故答案为:△H1-△H2;$\frac{{K}_{1}}{{K}_{2}}$;吸热;
(2)①Fe(s)+CO2(g)?FeO(s)+CO(g)
开始 1.5 0
转化 1 1
平衡 0.5 1
该反应 的平衡常数K=$\frac{1}{0.5}$=2.0,
故答案为:2.0;
②A.由表格中K1的变化,正反应为吸热反应,则升高温度,平衡正向移动,能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大,故A选;
B.增大压强,平衡不移动,故B不选;
C.充入一定量的CO2,平衡正向移动,但平衡时$\frac{c(CO)}{c(C{O}_{2})}$减小,故C不选;
D.再加入一定量铁粉,平衡不移动,故D不选;
故答案为:A;
③a.该反应为体积不变的反应,容器中压强始终不变,不能判定平衡状态,故不选;
b.体积不变,但质量为变量,气体的密度不再改变,为平衡状态,故选;
c.v正(CO2)=v逆(CO),可知正逆反应速率相等,为平衡状态,故选;
d.c(CO2)=c(CO),与起始浓度、转化率有关,不能判定平衡状态,故不选;
e.容器内气体总物质的量始终不变,不能判定平衡状态,故不选;
故答案为:bc.
点评 本题考查化学平衡计算、反应热、平衡移动,为高频考点,把握化学平衡三段法、K的计算、平衡移动、图象及表格数据为解答的关键,侧重分析与应用能力的考查,注意表格数据及盖斯定律的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Al3+离子含有的核外电子数为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| C. | 10 LpH=l的硫酸溶液中含有的H+离子数为NA | |
| D. | 1L0.5mol/L的碳酸钠溶液中含有的CO32-离子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
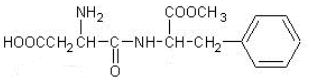
| A. | 分子式为C14H19N2O5 | B. | 既能与酸反应又能与碱反应 | ||
| C. | 不能发生水解反应 | D. | 1mol该物质最多可与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 1.0L0.1 mol•L-1 AlCl3溶液中所含的Al3+离子数为0.1NA | |
| C. | 标准状况下,11.2LSO3中含有分子数目为0.5NA | |
| D. | 常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | Ca(OH)2?Ca2++2OH- | ||
| C. | Fe2(SO4)3?2Fe2++3SO42- | D. | NaHCO3?Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入冷水中:Cl2+H2O?Cl-+ClO-+2H+ | |
| B. | 亚硫酸氨溶液与足量氢氧化钠溶液反应 HSO3-+OH-═SO32-+H2O | |
| C. | 氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2═HCO3- | |
| D. | 碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com