
| A、1 mol Na2O2与水完全反应时转移电子的数目为NA |
| B、标准状况下,22.4 L水中含有水分子的数目为NA |
| C、将0.1 mol FeCl3水解制成胶体,所得胶体粒子数为0. 1NA |
| D、1 L 0.1 mol?L-1乙酸溶液中H+数为0.1NA |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| A、加适量的醋酸钾晶体后,两溶液的pH均增大 |
| B、使温度都升高20℃后,两溶液的pH均不变 |
| C、加水稀释100倍后,盐酸的pH增大幅度大 |
| D、加足量的锌充分反应后,两溶液中产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的第一电离能是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的电离能逐渐增大 |
| B、元素的电负性是衡量元素在化合物中吸引电子能力大小的一种标度,同主族从上到下元素的电负性逐渐减小 |
| C、元素的性质随着原子序数的增大而呈周期性变化 |
| D、鲍林的电负性是以氟的电负性为4.0和锂的电负性为1.0作为相对标准得出的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-+H2O?HCO3-+OH- 热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)+3H+明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?xH2O↓+4HCl 用TiCl制备TiO |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 0.1mol?L-1的氨水含有0.1NA个OH- |
| B、23g NO2和N2O4的混合气体中含有氮原子数为0.5NA |
| C、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA |
| D、在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
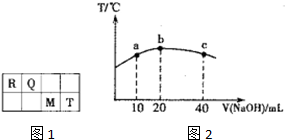 短周期元素R、Q、M、T在元素周期表中的相对位置如图1,已知R原子最外层电子数与次外层电子数之比为2:1.
短周期元素R、Q、M、T在元素周期表中的相对位置如图1,已知R原子最外层电子数与次外层电子数之比为2:1.| +X |
| +X |
| 化合反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com