
| A、加适量的醋酸钾晶体后,两溶液的pH均增大 |
| B、使温度都升高20℃后,两溶液的pH均不变 |
| C、加水稀释100倍后,盐酸的pH增大幅度大 |
| D、加足量的锌充分反应后,两溶液中产生的氢气一样多 |


科目:高中化学 来源: 题型:
| 不纯物 | 除杂试剂 | 分离方法 |
| 苯(苯酚) | ||
| 乙醇(水) | ||
| 乙烷(乙烯) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取所需的浓硫酸时仰视读数 |
| B、定容后摇匀,发现液面最低点低于刻度线,再补加几滴蒸馏水至刻度线 |
| C、定容时,俯视刻度线 |
| D、未冷却至室温就进行后续操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、给试管内的液体加热,可使试管口对准自己,不能使试管口对准别人 |
| B、用KMnO4制取O2时,先检验装置的气密性,然后再加药品 |
| C、把NaOH固体直接放在天平的左盘上称量 |
| D、稀释浓H2SO4时,可向盛浓H2SO4的量筒中小心加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发结晶时,应将溶液蒸干 |
| B、蒸馏中,应使温度计水银球靠近蒸馏烧瓶支管口处 |
| C、分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 |
| D、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
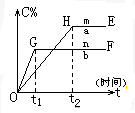 对于反应xA(g)+yB(g)?pC(g)+qD(g)压强与温度对C的质量分数的影响如图:
对于反应xA(g)+yB(g)?pC(g)+qD(g)压强与温度对C的质量分数的影响如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①② | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
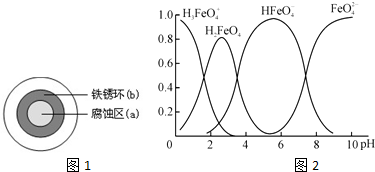
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Na2O2与水完全反应时转移电子的数目为NA |
| B、标准状况下,22.4 L水中含有水分子的数目为NA |
| C、将0.1 mol FeCl3水解制成胶体,所得胶体粒子数为0. 1NA |
| D、1 L 0.1 mol?L-1乙酸溶液中H+数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com