
| A、1 L 0.1mol?L-1的氨水含有0.1NA个OH- |
| B、23g NO2和N2O4的混合气体中含有氮原子数为0.5NA |
| C、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA |
| D、在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA |


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
| A、蒸发结晶时,应将溶液蒸干 |
| B、蒸馏中,应使温度计水银球靠近蒸馏烧瓶支管口处 |
| C、分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 |
| D、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、陶瓷、水泥和光导纤维均属于硅酸盐材料 |
| B、Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
| C、常温下,浓硫酸、浓硝酸与铝均能发生钝化,均能用铝罐储运 |
| D、NaClO和明矾都能作消毒剂或净水剂,加入酚酞试液均显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg>Al>Fe |
| B、Mg<Al<Fe |
| C、Fe>Mg>AL |
| D、Fe<Mg<Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Na2O2与水完全反应时转移电子的数目为NA |
| B、标准状况下,22.4 L水中含有水分子的数目为NA |
| C、将0.1 mol FeCl3水解制成胶体,所得胶体粒子数为0. 1NA |
| D、1 L 0.1 mol?L-1乙酸溶液中H+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28 g乙烯和28g丙烯中均含有6NA对共用电子对 |
| B、在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA |
| C、7.8 g Na2O2含有的阴离子数目为0.2 NA |
| D、在1L浓度为0.1mol?L-的NaCO3溶液中所含阴离子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu(OH)2+2HCl═CuCl2+2H2O Cu(OH)2+2H+═Cu2++2H2O |
| B、FeSO4+Ba(OH)2═Fe(OH)2↓+BaSO4↓ Fe2++SO42-+Ba2++2OH-═Fe(OH)2↓+BaSO4↓ |
| C、Ba(OH)2+H2SO4═BaSO4↓+2H2O Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| D、2HCl+Fe(OH)2═Fe2++2H2O 2H++Fe(OH)2═Fe2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
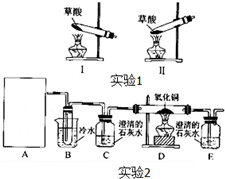 菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4?2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.
菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4?2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入 | |
| 步骤2: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com