
| 0.12mol/L×VL-0.1mol/L |
| 2V |
| 1×10-14 |
| 0.01 |


科目:高中化学 来源: 题型:
| A、υ(NH3)=0.8mol/(L?s) |
| B、υ(O2)=1.0mol/(L?s) |
| C、υ(NO)=1.0mol/(L?s) |
| D、υ(H2O)=1.8mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
| A、Cl2 |
| B、Br2 |
| C、I2 |
| D、H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9:1 | B、1:9 |
| C、1:7 | D、7:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 0.1mol?L-1的氨水含有0.1NA个OH- |
| B、23g NO2和N2O4的混合气体中含有氮原子数为0.5NA |
| C、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA |
| D、在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃和101KPa的条件下,4.9LCH4完全燃烧生成的H2O的分子数为0.4NA |
| B、1molNH3中含有3NA对电子对 |
| C、Na2O2与H2O反应生成标准状况下11.2 L O2时,转移的电子数为2NA |
| D、标准状况下,2.24L HF中所含电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、结构示意图为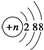 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | ||
B、球棍模型为: 的分子可发生加成反应 的分子可发生加成反应 | ||
C、符号为
| ||
D、电子式分别为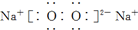 和 和 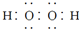 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com