
A、结构示意图为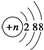 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | ||
B、球棍模型为: 的分子可发生加成反应 的分子可发生加成反应 | ||
C、符号为
| ||
D、电子式分别为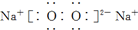 和 和  的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
 为硫离子,硫离子能够破坏水的电离平衡;
为硫离子,硫离子能够破坏水的电离平衡; 为比例模型;
为比例模型; 的阴离子中,当n=16时,表示的为硫离子,硫离子能够结合水电离的氢离子,破坏了水的电离平衡,故A错误;
的阴离子中,当n=16时,表示的为硫离子,硫离子能够结合水电离的氢离子,破坏了水的电离平衡,故A错误; 为比例模型,不是球棍模型,故B错误;
为比例模型,不是球棍模型,故B错误;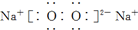 和
和 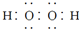 的两种化合物中O元素都为-1价,可以得电子,故都可作为氧化剂,故D正确;
的两种化合物中O元素都为-1价,可以得电子,故都可作为氧化剂,故D正确;

科目:高中化学 来源: 题型:
| A、少量金属钠放入冷水中 Na+2H2O=Na++2OH-+H2↑ |
| B、水溶液中NaHCO3的电离:HCO3-?CO32-+H+ |
| C、碳酸氢铵溶液和氢氧化钠溶液等物质的量浓度、等体积混合 NH4++OH-═NH3?H2O |
| D、硫酸铜溶液和氢氧化钡溶液混合 Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏水 |
| B、0.5 mol?L-1硫酸镁溶液 |
| C、0.5 mol?L-1氯化钾溶液 |
| D、0.5 mol?L-1盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1 mol任何气体体积均约为22.4 L |
| B、同温、同压下,体积相同的两种气体单质具有相同的分子数目 |
| C、将73 g HCl溶于1 L水中配成溶液,所得溶液物质的量浓度是2 mol?L-1 |
| D、含NA个Na+的Na2O溶解于水配成1 L溶液,Na+的物质的量浓度为1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
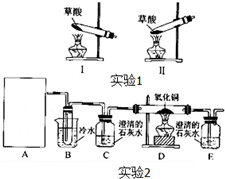 菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4?2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.
菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4?2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入 | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com