考点:阿伏加德罗定律及推论,物质的量浓度的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律,物质的量浓度和溶解度专题
分析:A.标况下,气体摩尔体积是22.4L/mol,根据V=nV
m知,气体体积与物质的量成正比;
B.同温同压下,气体摩尔体积相等,根据N=nN
A=
NA计算其分子数之比;
C.73gHCl的物质的量是2mol,溶于1L水时,溶液的体积大于1L,根据C=
计算其物质的量浓度;
D.含N
A个Na
+的Na
2O的物质的量=
=0.5mol,溶解于水配成1 L溶液,根据C=
计算其物质的量浓度.
解答:
解:A.标况下,气体摩尔体积是22.4L/mol,根据V=nV
m知,气体体积与物质的量成正比,所以1 mol任何气体体积均约为22.4 L,故A正确;
B.同温同压下,气体摩尔体积相等,根据N=nN
A=
NA知,相同体积时其分子个数相等,故B正确;
C.73gHCl的物质的量是2mol,溶于1L水时,溶液的体积大于1L,根据C=
知,其物质的量浓度小于2mol/L,故C错误;
D.含N
A个Na
+的Na
2O的物质的量=
=0.5mol,溶解于水配成1 L溶液,C=
=
=0.5mol/L,故D正确;
故选C.
点评:本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,易错选项是C,注意物质的量浓度公式中V指溶液体积而不是溶剂体积,为易错点.



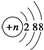 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡 的分子可发生加成反应
的分子可发生加成反应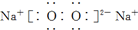 和
和 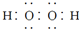 的两种化合物均为常见的氧化剂
的两种化合物均为常见的氧化剂