
| ||
| ||
| ||
| ||


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、标准状况下,1 mol任何气体体积均约为22.4 L |
| B、同温、同压下,体积相同的两种气体单质具有相同的分子数目 |
| C、将73 g HCl溶于1 L水中配成溶液,所得溶液物质的量浓度是2 mol?L-1 |
| D、含NA个Na+的Na2O溶解于水配成1 L溶液,Na+的物质的量浓度为1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z为0.3mol/L |
| B、Y2为0.4mol/L |
| C、X2为0.2mol/L |
| D、Z为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O3,Zn/H2O |
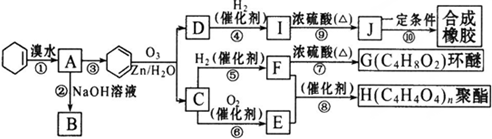
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
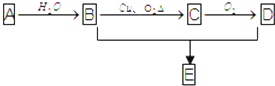
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:调节溶液A至弱碱性,滴加足量CaCl2溶液. | ①出现白色沉淀,说明菠菜中 |
| 步骤2:取步骤1的沉淀于试管中,加入足量的稀硫酸,沉淀完全溶解,并将产生的无色无味的气体通入澄清石灰水中. | ② |
| 步骤3:向步骤2得到的溶液中滴加几滴高锰酸钾溶液. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com