



 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
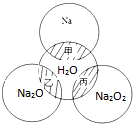 如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )
如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )| A、甲乙丙反应都属于氧化还原反应 |
| B、丙反应中的氧化剂是Na2O2,还原剂是H20 |
| C、丙反应中若消耗1molNa2O2,则转移2moL的电子 |
| D、甲乙丙反应后所得溶液的质量分数分别为ω1、ω2、ω3,则2ω1>ω2=ω3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
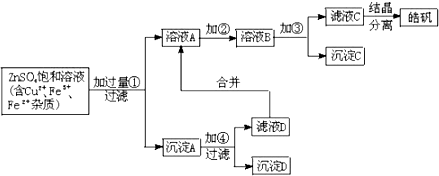
查看答案和解析>>
科目:高中化学 来源: 题型:
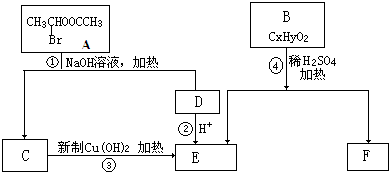
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去SO2中少量HCl的方法是:将混合气体通过盛有NaHSO3饱和溶液的洗气瓶 |
| B、用蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口,有大量白烟,说明该无机酸一定为盐酸 |
| C、向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,则该无色溶液一定是硝酸 |
| D、向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
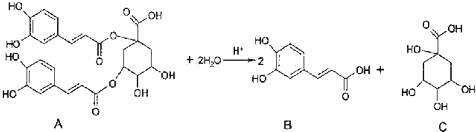
| A、A在一定条件下能发生取代反应、加成反应和消去反应 |
| B、1mol A和足量NaOH溶液反应,最多消耗11molNaOH |
| C、B能和浓溴水发生反应,1mol B最多消耗4 molBr2 |
| D、C分子中含有手性碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com