
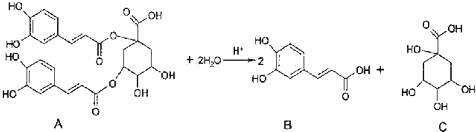
| A、A在一定条件下能发生取代反应、加成反应和消去反应 |
| B、1mol A和足量NaOH溶液反应,最多消耗11molNaOH |
| C、B能和浓溴水发生反应,1mol B最多消耗4 molBr2 |
| D、C分子中含有手性碳原子 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
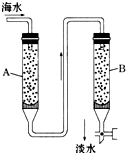 随着现代科学的不断发展,生产和生活所需淡水日益增多,甚至超过人类所能支配的淡水量,使地球上淡水资源发生危机,这就把海水淡化问题提到了科学家的面前.磺化媒(代表式NaR)是一种钠型离子交换树脂,它能使海水中的Ca2+、Mg2+交换除去.
随着现代科学的不断发展,生产和生活所需淡水日益增多,甚至超过人类所能支配的淡水量,使地球上淡水资源发生危机,这就把海水淡化问题提到了科学家的面前.磺化媒(代表式NaR)是一种钠型离子交换树脂,它能使海水中的Ca2+、Mg2+交换除去.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示是实验进行石油蒸馏的装置,请回答下列问题
如图所示是实验进行石油蒸馏的装置,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
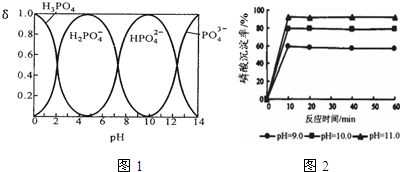
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) |
| B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=+57.3kJ/mol(中和热) |
| C、S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol (反应热) |
| D、2NO2=O2+2NO△H=+116.2kJ/mol (反应热) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com