
 ,则X位于周期表中第三周期ⅠA族;
,则X位于周期表中第三周期ⅠA族; ,则Y位于周期表中第二周期ⅣA族;
,则Y位于周期表中第二周期ⅣA族; ,则Z位于周期表中第二周期ⅤA族;
,则Z位于周期表中第二周期ⅤA族; ,则W位于周期表中第三周期ⅦA族,
,则W位于周期表中第三周期ⅦA族,

科目:高中化学 来源: 题型:
A、结构示意图为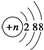 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | ||
B、球棍模型为: 的分子可发生加成反应 的分子可发生加成反应 | ||
C、符号为
| ||
D、电子式分别为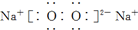 和 和 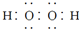 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
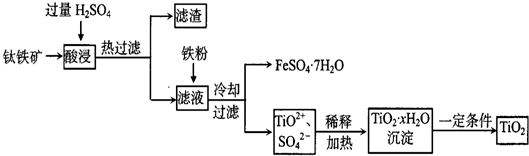
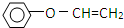 )是一种重要的化工原料,请回答下列问题:
)是一种重要的化工原料,请回答下列问题: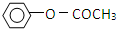 )的流程如下(条件略)
)的流程如下(条件略)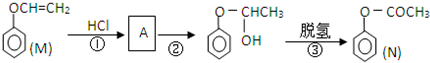
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
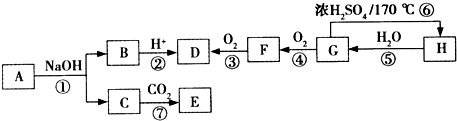
查看答案和解析>>
科目:高中化学 来源: 题型:
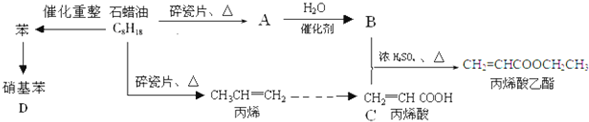
| NaOH |
| △ |
| 淀粉酶 |
| 酒化酶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
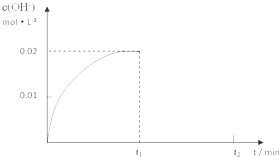
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com