
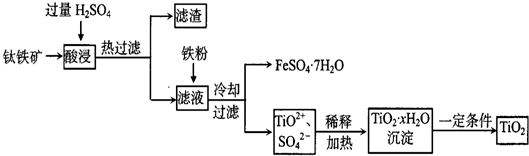
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
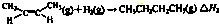
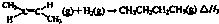
| 1 |
| 2 |
| 温度(℃) | 300 | 320 | 340 |
| k2 | 4.8×10-4 | 2.5×10-4 | 1.3×10-4 |
| k3 | 8.4×105 | 3.5×103 | 1.6×103 |
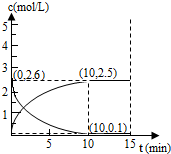
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:调节溶液A至弱碱性,滴加足量CaCl2溶液. | ①出现白色沉淀,说明菠菜中 |
| 步骤2:取步骤1的沉淀于试管中,加入足量的稀硫酸,沉淀完全溶解,并将产生的无色无味的气体通入澄清石灰水中. | ② |
| 步骤3:向步骤2得到的溶液中滴加几滴高锰酸钾溶液. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
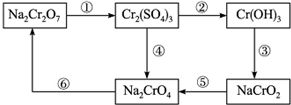
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验操作 | 实验目的 |
| A | 配制FeCl2溶液时,向溶液中加入少量Fe和稀盐酸 | 抑制Fe2+水解和防止Fe2+被氧化 |
| B | 将饱和FeCl3溶液滴入沸水中,溶液变红褐色 | 制备Fe(OH)3胶体 |
| C | 测定等浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大 | 比较S、C的非金属性强弱 |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 研究温度对化学平衡移动的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B、a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| C、NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| D、某浓度的NaCN溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com