��ϩ����Ҫ�Ļ���ԭ�ϣ����ͳ������ѽ����������ϩ�����⣬�Բ����ٴ��ѽ��������ϩ��������ؼӳɷ�Ӧ���£�
�٣�CH
3CH=CH
2��g��+H
2��g����CH
3CH
2CH
3��g����H
1=-125.4kJ?mol
-1�ڣ�
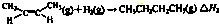
�ۣ�
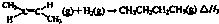
��ش��������⣺
��1���жϷ�Ӧ���ܷ��Է����У�
�������һ���¶����Է�����������һ���¶����Է��������κ��¶��¶����Է��������κ��¶��¶������Է�������
��2����֪��ʾH
2��CH
3CH
2CH
3��ȼ���ȵ��Ȼ�ѧ����ʽΪ��
H
2��g��+
O
2��g��=H
2O��l����H=-285.8kJ?mol
-1CH
3CH
2CH
3��g��+5O
2��g��=3CO
2��g��+4H
2O��l����H=-2215kJ?mol
-1���ʾCH
3CH=CH
2��ȼ���ȵ��Ȼ�ѧ����ʽΪ
��
��3����֪��Ӧ�ڡ���Ӧ��ƽ�ⳣ�����£�����������ȷ����
��
| �¶ȣ��棩 | 300 | 320 | 340 |
| k2 | 4.8��10-4 | 2.5��10-4 | 1.3��10-4 |
| k3 | 8.4��105 | 3.5��103 | 1.6��103 |
A����H
2��0����H
3��0
B����Ӧ�ڡ���Ӧ�۶��DZ�ϩ���⣬���ԡ�H
2=��H
3C����ͬ�����·�Ӧ�۵�ת���ʴ��ڷ�Ӧ�ڵ�ת����
D����ƽ�ⳣ���Ʋ⣬��ͬ�����·�Ӧ�۵ķ�Ӧ���ʺܴ�Ӧ�ڵķ�Ӧ���ʺ�С
��4����һ���¶��£��������ʵ����ķ�ʽ2-��ϩ��H
2����2L�ܱ������У�������Ӧ�ۣ������ڸ�����Ũ����ͼ��ʾ��
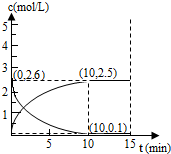
��ǰ10���ӣ�ƽ����Ӧ����v��H
2��Ϊ
mol?L
-1?min
-1�ڸ��¶��£��˷�Ӧƽ�ⳣ��K=
�۵�ʱ�䵽��15minʱ������ѹǿ�������������Ϊ1.25L������ͼ�л���15min�����Ũ�ȱ仯�������ߣ�

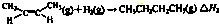
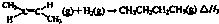

 ��
�� ��
��




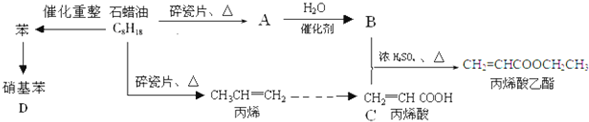
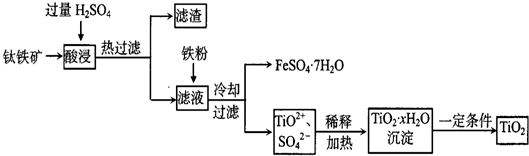
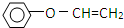 ����һ����Ҫ�Ļ���ԭ�ϣ���ش��������⣺
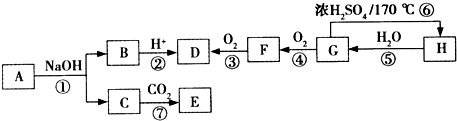
����һ����Ҫ�Ļ���ԭ�ϣ���ش��������⣺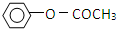 �����������£������ԣ�
�����������£������ԣ�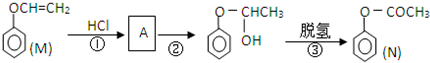
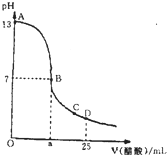 �����£���25mL 0.1mol/L NaOH��Һ����μ���0.2mol/L CH3COOH��Һ��������ͼ������������Һ���ʱ������仯���й�����Ũ�ȱȽϻ�˵����ȷ���ǣ�������
�����£���25mL 0.1mol/L NaOH��Һ����μ���0.2mol/L CH3COOH��Һ��������ͼ������������Һ���ʱ������仯���й�����Ũ�ȱȽϻ�˵����ȷ���ǣ�������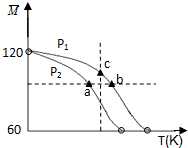 ��֪ ��CH3COOH��2��g��?2CH3COOH ��g������ʵ���ò�ͬѹǿ�£���ϵ��ƽ��Ħ��������
��֪ ��CH3COOH��2��g��?2CH3COOH ��g������ʵ���ò�ͬѹǿ�£���ϵ��ƽ��Ħ��������