
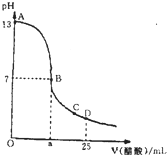
 室温下,向25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图,若忽略两溶液混合时的体积变化,有关粒子浓度比较或说法正确的是( )
室温下,向25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图,若忽略两溶液混合时的体积变化,有关粒子浓度比较或说法正确的是( )| A、在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、在B点时:a=12.5 |
| C、在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、在D点:c(CH3COO-)=c(CH3COOH) |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
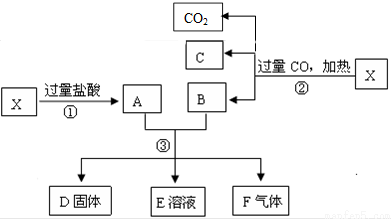
科目:高中化学 来源: 题型:
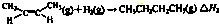
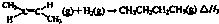
| 1 |
| 2 |
| 温度(℃) | 300 | 320 | 340 |
| k2 | 4.8×10-4 | 2.5×10-4 | 1.3×10-4 |
| k3 | 8.4×105 | 3.5×103 | 1.6×103 |
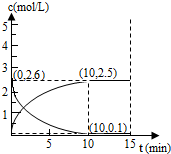
查看答案和解析>>
科目:高中化学 来源: 题型:
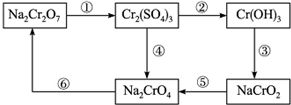
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验操作 | 实验目的 |
| A | 配制FeCl2溶液时,向溶液中加入少量Fe和稀盐酸 | 抑制Fe2+水解和防止Fe2+被氧化 |
| B | 将饱和FeCl3溶液滴入沸水中,溶液变红褐色 | 制备Fe(OH)3胶体 |
| C | 测定等浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大 | 比较S、C的非金属性强弱 |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 研究温度对化学平衡移动的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液起始读数 | NaOH溶液终点读数 | 盐酸体积 | |
| 第一次 | 0.10mL | 18.60mL | 20.00mL |
| 第二次 | 0.40mL | 19.00mL | 20.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
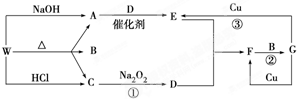
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)氢气是一种新型的绿色能源,又是一种重要的化工原料.氢气燃烧热值高.实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出 142.9kJ 热量.则能表示H2标准燃烧热的热化学方程式为
(1)氢气是一种新型的绿色能源,又是一种重要的化工原料.氢气燃烧热值高.实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出 142.9kJ 热量.则能表示H2标准燃烧热的热化学方程式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com