


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为: |
| 乙小组 | | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
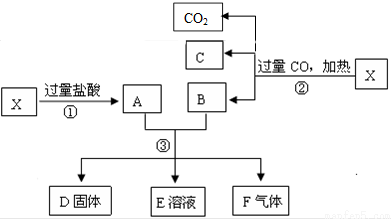
科目:高中化学 来源: 题型:
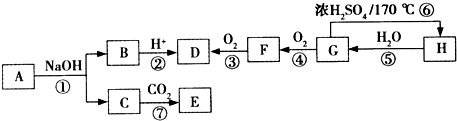
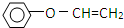 )是一种重要的化工原料,请回答下列问题:
)是一种重要的化工原料,请回答下列问题: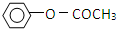 )的流程如下(条件略)
)的流程如下(条件略)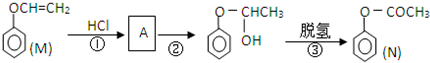
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
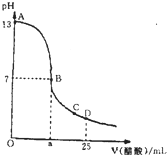 室温下,向25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图,若忽略两溶液混合时的体积变化,有关粒子浓度比较或说法正确的是( )
室温下,向25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图,若忽略两溶液混合时的体积变化,有关粒子浓度比较或说法正确的是( )| A、在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、在B点时:a=12.5 |
| C、在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、在D点:c(CH3COO-)=c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com