解答:
解:A、B、C、D、E、F六种短周期元素,其原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,最外层电子数不超过8个,则C元素次外层为K层,则C原子含有8个电子,为O元素;
D是所在周期原子半径最大的主族元素,且原子序数大于C,所以D是Na元素;
C与F同主族,且F原子序数大于C,所以F是S元素;
A和D同一主族,A原子序数最小,则A可能是H元素或Li元素;
六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,则只能是A、B元素单质是气体,则A是H元素、B是N元素;
D与E和F同周期,且E原子序数大于D而小于F,其单质为固体,则E可能是Mg、Al、S或P元素;
(1)离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,O、Na离子电子层结构相同且Na元素原子序数大于O元素,所以离子半径:O2->Na+,S离子核外有3个电子层,O、Na离子核外有2个电子层,所以O、Na、S三种元素形成的简单离子的半径由大到小的顺序是:S
2->O
2->Na
+,
故答案为:S
2->O
2->Na
+;
(2)由H、N两种元素以原子个数比5:1形成离子化合物NH
4H,该化合物中氢离子和铵根离子之间存在离子键、铵根离子中N原子和H原子之间存在共价键,X的电子式为
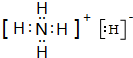
,
故答案为:
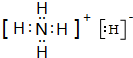
;
(3)由H、N元素形成的化合物N
2H
4可以与O
2、KOH溶液形成原电池,原电池中负极上燃料失电子发生氧化反应生成氮气和水,电极反应式为N
2H
4-4e
-+4OH
-=N
2+4H
2O,故答案为:N
2H
4-4e
-+4OH
-=N
2+4H
2O;
(4)①若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,则E是Al元素,高温下,铝和氧化铁发生置换反应生成氧化铝和铁,反应方程式为2Al+Fe
2O
32Fe+Al
2O
3,故答案为:2Al+Fe
2O
32Fe+Al
2O
3;
②若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,二氧化硅晶体中每个Si原子价层电子对个数是4且不含孤电子对,所以Si原子杂化方式为sp
3,故答案为:sp
3;
(5)由H、O、Na、S四种元素形成的化合物Y(NaHSO
3)(已知H
2SO
3的Ka
1=1.3×10
-2、Ka
2=6.3×10
-8),亚硫酸氢根离子电离程度大于生成程度导致溶液呈碱性,但水解和电离程度都较小,钠离子不水解,水也电离出氢离子,所以溶液中离子浓度大小顺序是c(Na
+)>c(HSO
3-)>c(H
+)>c(SO
32-)>c(OH
-);
向Y溶液中加入一定量的NaOH,使溶液中c(HSO
3-)=c(SO
32-),亚硫酸根离子水解程度大于亚硫酸氢根离子电离程度,所以溶液呈碱性;
用惰性电极电解NaHSO
3的水溶液,阳极无气体产生,则阳极上亚硫酸氢根离子失电子生成硫酸根离子,
电极反应式为HSO
3--2e
-+H
2O=SO
42-+3H
+,
故答案为:c(Na
+)>c(HSO
3-)>c(H
+)>c(SO
32-)>c(OH
-);碱性;HSO
3--2e
-+H
2O=SO
42-+3H
+.

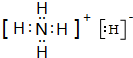 ,
,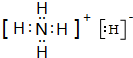 ;
;

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案