
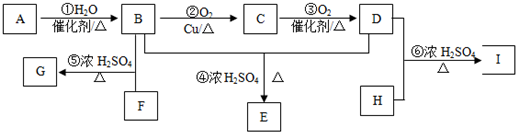
 ,F与足量的B发生酯化反应生成G为
,F与足量的B发生酯化反应生成G为 ,H为二元醇,其蒸气密度折算成标准状况为2.77g/L,其相对分子质量为22.4×2.77=62,去掉2个羟基剩余基团式量为62-17×2=28,故为-C2H4-,则H为HOCH2CH2OH,H与足量D反应生成I为
,H为二元醇,其蒸气密度折算成标准状况为2.77g/L,其相对分子质量为22.4×2.77=62,去掉2个羟基剩余基团式量为62-17×2=28,故为-C2H4-,则H为HOCH2CH2OH,H与足量D反应生成I为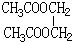 ,据此解答.
,据此解答. ,F与足量的B发生酯化反应生成G为
,F与足量的B发生酯化反应生成G为 ,H为二元醇,其蒸气密度折算成标准状况为2.77g/L,其相对分子质量为22.4×2.77=62,去掉2个羟基剩余基团式量为62-17×2=28,故为-C2H4-,则H为HOCH2CH2OH,H与足量D反应生成I为
,H为二元醇,其蒸气密度折算成标准状况为2.77g/L,其相对分子质量为22.4×2.77=62,去掉2个羟基剩余基团式量为62-17×2=28,故为-C2H4-,则H为HOCH2CH2OH,H与足量D反应生成I为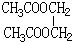 ,
, ,其分子式为C12H14O4,反应⑤是羧酸与醇发生的酯化反应,也属于取代反应,故答案为:C12H14O4;酯化反应或取代反应;
,其分子式为C12H14O4,反应⑤是羧酸与醇发生的酯化反应,也属于取代反应,故答案为:C12H14O4;酯化反应或取代反应;| Cu |
| △ |
| 浓硫酸 |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
 与HOCH2CH2OH发生缩聚反应生成高分子化合物,该化学反应方程式为:
与HOCH2CH2OH发生缩聚反应生成高分子化合物,该化学反应方程式为: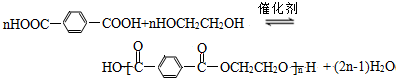 ,
,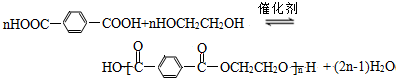 ;
;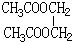 )有多种同分异构体,其中一类同分异构体有如下特征:
)有多种同分异构体,其中一类同分异构体有如下特征: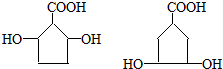 ,
,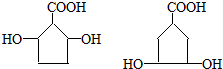 .
.


科目:高中化学 来源: 题型:
| A、常温下可发生反应2M2++Z2═2M3++2Z- |
| B、还原性强弱顺序为:X2+<Z-<R-<M2+ |
| C、Z元素在反应①中被氧化,在③中被还原 |
| D、氧化性强弱顺序为:XO4-<Z2<R2<M3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||
| B | C | D |
| 催化剂 |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向澄清石灰水中加入等物质的量的NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
| B、向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3?H2O+H2O |
| C、氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
| D、氯化铝溶液中加入过量氨水Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.25℃时,在20ml Ba(OH)2溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,试回答以下问题:
Ⅰ.25℃时,在20ml Ba(OH)2溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②⑥⑦ |
| C、③④⑤ | D、④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com