
| A、①②③ | B、②⑥⑦ |
| C、③④⑤ | D、④⑤⑦ |
科目:高中化学 来源: 题型:
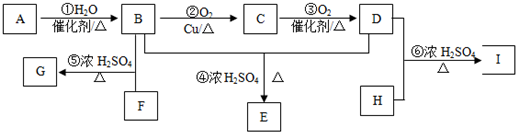
查看答案和解析>>
科目:高中化学 来源: 题型:

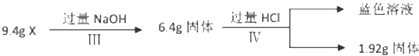
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中(放有等质量的纸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液起始读数 | NaOH溶液终点读数 | 盐酸体积 | |
| 第一次 | 0.10mL | 18.60mL | 20.00mL |
| 第二次 | 0.40mL | 19.00mL | 20.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、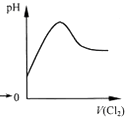 表示Cl2通入SO2溶液中pH的变化 |
B、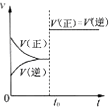 表示已达平衡的某可逆反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
C、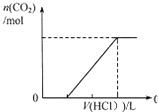 表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol?L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
D、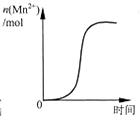 表示10 mL 0.01 mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.1mol/L(NH4)2Fe(SO4)2的溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(OH-)>c(H+) |
| B、在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| C、常温下,CH3COONa溶液和盐酸混合所得中性溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
| D、25℃时,pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(C2O42-)>c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液 |
| △ |
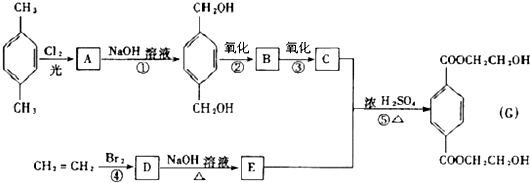
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com