
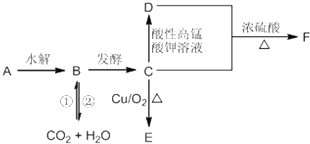
| 1mol×180g/mol |
| 1g |
| 浓硫酸 |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| Cu |
| △ |


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
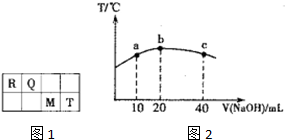 短周期元素R、Q、M、T在元素周期表中的相对位置如图1,已知R原子最外层电子数与次外层电子数之比为2:1.
短周期元素R、Q、M、T在元素周期表中的相对位置如图1,已知R原子最外层电子数与次外层电子数之比为2:1.| +X |
| +X |
| 化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
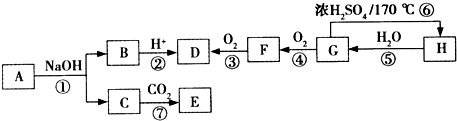
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.25℃时,在20ml Ba(OH)2溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,试回答以下问题:
Ⅰ.25℃时,在20ml Ba(OH)2溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中滴加FeCl3的稀溶液,以制备Fe(OH)3胶体 |
| B、用盐酸滴定氢氧化钠,用酚酞作指示剂,当锥形瓶中溶液由无色变成红色时即达到滴定终点 |
| C、室温下,用pH试纸测定浓度为0.1 mol?L-1 NaClO溶液和0.1 mol?L-1 CH3COONa溶液的pH,比较HClO和CH3COOH的酸性强弱 |
| D、室温下,向Mg(OH)2中加入饱和氯化铵溶液能使Mg(OH)2溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com