
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2: | |
| 步骤3: |
| 实验步骤 | 预期现象或结论 |
| 加入过量盐酸 | 有浅黄色浑浊出现、有刺激性气体产生 |
| 静置后取上层清液,加入BaCl2溶液 | 有白色沉淀产生,说明样品中含有SO42- |
| 10×0.01×6 |
| 12 |
| 0.79 |
| 1.0 |


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盛待测液的锥形瓶滴定前用待测液润洗 |
| B、滴定管尖嘴部分在滴定前有气泡,滴定后气泡消失 |
| C、滴定到达终点时,视线高于滴定管内凹液面的最低点读数 |
| D、滴定管在滴定前未将液面调至“0”刻度除,而是在“2.40”刻度处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
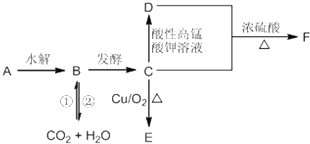
查看答案和解析>>
科目:高中化学 来源: 题型:
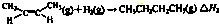
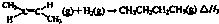
| 1 |
| 2 |
| 温度(℃) | 300 | 320 | 340 |
| k2 | 4.8×10-4 | 2.5×10-4 | 1.3×10-4 |
| k3 | 8.4×105 | 3.5×103 | 1.6×103 |
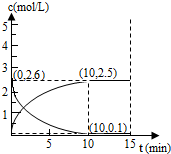
查看答案和解析>>
科目:高中化学 来源: 题型:

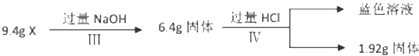
查看答案和解析>>
科目:高中化学 来源: 题型:
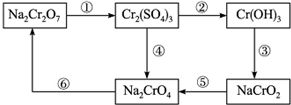
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液起始读数 | NaOH溶液终点读数 | 盐酸体积 | |
| 第一次 | 0.10mL | 18.60mL | 20.00mL |
| 第二次 | 0.40mL | 19.00mL | 20.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Kw |
| B、c(H+)/Ka |
| C、c(HA)/c(A-) |
| D、c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com