
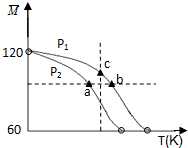
 已知 (CH3COOH)2(g)?2CH3COOH (g),经实验测得不同压强下,体系的平均摩尔质量(
已知 (CH3COOH)2(g)?2CH3COOH (g),经实验测得不同压强下,体系的平均摩尔质量(. |
| M |
| m总 |
| n总 |
| A、该过程的△H<0 |
| B、气体压强:P(a)<P(b)=P(c) |
| C、平衡常数:K(a)=K(b)<K(c) |
| D、测定乙酸的相对分子质量要在高压、低温条件 |


科目:高中化学 来源: 题型:
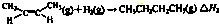
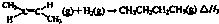
| 1 |
| 2 |
| 温度(℃) | 300 | 320 | 340 |
| k2 | 4.8×10-4 | 2.5×10-4 | 1.3×10-4 |
| k3 | 8.4×105 | 3.5×103 | 1.6×103 |
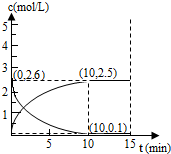
查看答案和解析>>
科目:高中化学 来源: 题型:
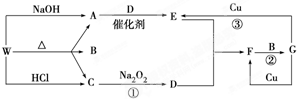
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的度的2倍 |
| B、保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 |
| C、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| D、保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Kw |
| B、c(H+)/Ka |
| C、c(HA)/c(A-) |
| D、c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B、a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| C、NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| D、某浓度的NaCN溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)氢气是一种新型的绿色能源,又是一种重要的化工原料.氢气燃烧热值高.实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出 142.9kJ 热量.则能表示H2标准燃烧热的热化学方程式为
(1)氢气是一种新型的绿色能源,又是一种重要的化工原料.氢气燃烧热值高.实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出 142.9kJ 热量.则能表示H2标准燃烧热的热化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在c(H+)/c(OH-)=1×10-14的溶液中:NH4+、Ca2+、Cl-、K+ |
| B、水电离的c(H+)=10-13mol?L-1的溶液中:Fe3+、SO42-、K+、SCN- |
| C、在c(H+)=10-14mol/L的溶液中可能含:Na+,AlO22-,CO32-,SO32- |
| D、c(OH-)=1×10-14mol/L的溶液中:Na+、K+、Cl-、S2O32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com