
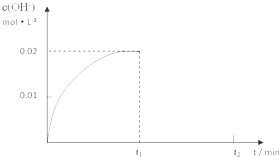
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| 0.02mol/L×0.02mol/L |
| 1mol/L-0.02mol/L |
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| x2 |
| 0.5mol/L-x |
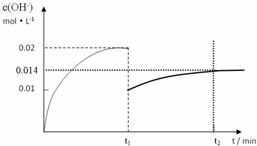 ,答:t1~t2时间内OH-浓度随时间变化的曲线为
,答:t1~t2时间内OH-浓度随时间变化的曲线为 ;
;| b |
| 2 |
| a |
| 2 |
| b |
| 2 |
| a-b |
| 2 |
| a-b |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验操作 | 实验目的 |
| A | 配制FeCl2溶液时,向溶液中加入少量Fe和稀盐酸 | 抑制Fe2+水解和防止Fe2+被氧化 |
| B | 将饱和FeCl3溶液滴入沸水中,溶液变红褐色 | 制备Fe(OH)3胶体 |
| C | 测定等浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大 | 比较S、C的非金属性强弱 |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 研究温度对化学平衡移动的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
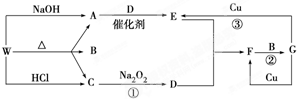
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的度的2倍 |
| B、保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 |
| C、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| D、保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B、a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| C、NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| D、某浓度的NaCN溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com