
| A、Z为0.3mol/L |
| B、Y2为0.4mol/L |
| C、X2为0.2mol/L |
| D、Z为0.4mol/L |


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:
| A、已知H2SO3的Ka1大于HClO的Ka NaClO+H2O+SO2═Na2SO3+HClO | ||||
| B、碳酸氢钠水解 HCO3-+H2O?H3O++CO32- | ||||
C、实验室制备氢氧化铁胶体 Fe3++3H2O
| ||||
| D、向NaHSO4溶液中加入Ba(OH)2溶液至刚好呈中性 H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
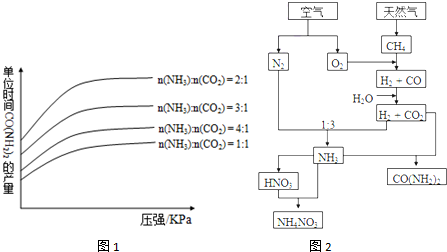
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
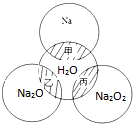 如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )
如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )| A、甲乙丙反应都属于氧化还原反应 |
| B、丙反应中的氧化剂是Na2O2,还原剂是H20 |
| C、丙反应中若消耗1molNa2O2,则转移2moL的电子 |
| D、甲乙丙反应后所得溶液的质量分数分别为ω1、ω2、ω3,则2ω1>ω2=ω3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
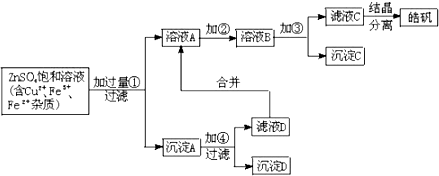
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
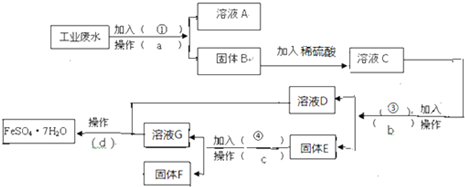
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com