菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H
2C
2O
4?2H
2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.
他们设计的实验步骤如下:
(1)将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl
2溶液,产生白色沉淀,过滤、洗涤.沉淀备用,对生成的沉淀进行探究.
①提出合理假设:
假设1:只存在:CaCO
3;假设2:既存在CaCO
3,也存在CaC
2O
4;假设3:
.
②基于假设2,设计实验方案,进行实验探究.请将实验步骤以及预期现象和结论填入表中.限选实验试剂:1mol?L
-1溶液、0.1mol?L
-1HCl溶液、O.O1mol?L
-1 KMnO
4溶液、澄清石灰水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入 | |
| 步骤2: | |
(2)用草酸晶体(H
2C
2O
4?2H
2O)做以下实验,请回答以下问题:
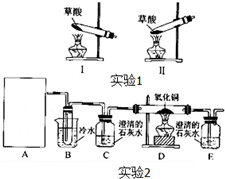
①A处应选择
(填“I”或“Ⅱ”),在做实验之前,应先
.
②实验2过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中草酸晶体(H
2C
2O
4?2H
2O)发生反应的化学方程式:
.
③为使实验结论更加严密和安全,在以上所连接的装置C、D间还需依添加装有
(液体试剂)的洗气瓶,此外指出上述装置中的不足之处还有
(3)欲测定草酸晶体样品中H
2C
2O
4?2H
2O的含量,称取0.6g该样品,加100mL水使其完全溶解后平均分成5份,其中一份用0.0200moL?L
-1的酸性KMnO
4溶液滴定至终点,(杂质不参与反应),消耗酸性溶液16.00mL,则该草酸晶体样品中H
2C
2O
4?2H
2O的质量分数是
.

 菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4?2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.
菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4?2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案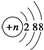 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡 的分子可发生加成反应
的分子可发生加成反应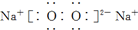 和
和 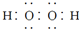 的两种化合物均为常见的氧化剂
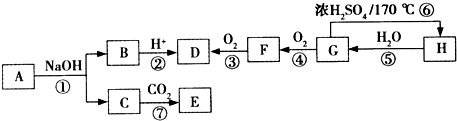
的两种化合物均为常见的氧化剂 短周期元素R、Q、M、T在元素周期表中的相对位置如图1,已知R原子最外层电子数与次外层电子数之比为2:1.
短周期元素R、Q、M、T在元素周期表中的相对位置如图1,已知R原子最外层电子数与次外层电子数之比为2:1.