
下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO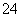 )>c(NH
)>c(NH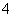 )
)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
解析:A项,稀氨水和稀硫酸混合后所得溶液中存在NH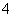 、OH-、H+、SO
、OH-、H+、SO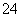 ,当溶液pH=7时,c(H+)=c(OH-),由电荷守恒知:c(H+)+c(NH
,当溶液pH=7时,c(H+)=c(OH-),由电荷守恒知:c(H+)+c(NH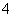 )=2c(SO
)=2c(SO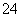 )+c(OH-),得c(NH
)+c(OH-),得c(NH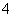 )=2c(SO
)=2c(SO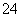 ),故c(NH
),故c(NH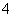 )>c(SO
)>c(SO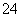 );B项,由pH知前者溶液中c(H+)是后者溶液中c(H+)的10倍,因醋酸是弱酸,溶液越稀越电离,故c1大于10c2;C项,由pH知NaOH溶液中c(OH-)等于醋酸溶液中c(H+),因醋酸是弱酸,部分电离,故NaOH溶液中溶质的浓度小于醋酸溶液中溶质的浓度,故两者等体积混合时,醋酸过量,溶液呈酸性,遇到紫色石蕊试液变红;D项,电离平衡常数Kb=c(NH
);B项,由pH知前者溶液中c(H+)是后者溶液中c(H+)的10倍,因醋酸是弱酸,溶液越稀越电离,故c1大于10c2;C项,由pH知NaOH溶液中c(OH-)等于醋酸溶液中c(H+),因醋酸是弱酸,部分电离,故NaOH溶液中溶质的浓度小于醋酸溶液中溶质的浓度,故两者等体积混合时,醋酸过量,溶液呈酸性,遇到紫色石蕊试液变红;D项,电离平衡常数Kb=c(NH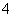 )·c(OH-)/c(NH3·H2O),温度一定时Kb是一定值,加入固体硫酸铵后,溶液中c(NH
)·c(OH-)/c(NH3·H2O),温度一定时Kb是一定值,加入固体硫酸铵后,溶液中c(NH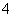 )增大,故c(OH-)/c(NH3·H2O)减小。
)增大,故c(OH-)/c(NH3·H2O)减小。
答案:C


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
下列电离方程式错误的是( )
A.Na2CO3 2Na++CO32- B.NaHCO3 Na++HCO3-
C.H2SO4 2H++SO42- D.KClO3 K++Cl-+3O2-
| |
查看答案和解析>>
科目:高中化学 来源: 题型:
丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1g/mL,沸点约55oC,分离水和丙酮时最合理的方法是 ( )
A.蒸发 B.蒸馏 C.过滤 D.分液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用NaOH固体配制250mL1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250mL1.25mol/L的NaOH溶液
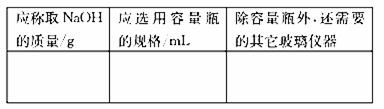 |
(2)容量瓶上需标有以下五项中的
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
A、用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(4)操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为
(5)下列配制的溶液浓度偏小的是
A、向容量瓶中转移溶液时(实验步骤②)不慎有液滴洒在容量瓶外面
B、加蒸馏水时不慎超过了刻度线、
C、定容时俯视刻度线
D、配制前,容量瓶中有少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子,在指定的环境中能够大量共存的是( )
| 选项 | 指定环境 | 能够共存的离子 |
| A | 滴加酚酞显红色的溶液 | K+、S2-、SO |
| B | 有HCO | Na+、K+、Cl-、Al3+ |
| C | 水电离的c(H+)=10-12 mol·L-1的溶液中 | Cl-、CO NO |
| D | 使石蕊变红的溶液中 | Fe2+、MnO NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | c(HA)/mol·L-1 | c(NaOH)/mol·L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是( )
A.a>9
B.在乙组混合液中由水电离出的c(OH-)=10-5 mol·L-1
C.c1=0.2
D.丁组混合液中:c(Na+)>c(A-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
现将0.04 mol·L-1的某酸(A)溶液和0.02 mol·L-1 NaOH溶液等体积混合得混合溶液Q。
(1)若A为CH3COOH,Q呈酸性,溶液中所有离子按浓度由大到小排列的顺序是________;若A为HCl,100℃时(KW=10-12),溶液中由水电离出的H+浓度为________mol·L-1;若A为H2S,Q接近中性,则HS-的电离能力________水解能力(填“>”、“<”、“=”或“无法确定”)。
(2)根据(1)中信息比较相同条件下,浓度均为0.01 mol·L-1的①NaHS、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为________(填序号)。
(3)用浓度为0.01 mol·L-1的NaOH溶液滴定相同体积、相同浓度的①HCl溶液、②CH3COOH溶液、③H2S溶液,当滴定至中性时,消耗NaOH溶液的体积分别为a mL、b mL、c mL,则a、b、c的大小关系是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在给定的四种溶液中加入以下各种离子,各离子能在原溶液中大量共存的是( )
A.滴加甲基橙显红色的溶液:Fe3+、NH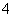 、Cl-、SCN-
、Cl-、SCN-
B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO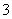
C.水电离出来的c(H+)=10-13 mol/L的溶液:K+、HCO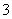 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+、CO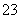 、NO
、NO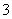 、Pb2+
、Pb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.6 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末收集到氢气1.12 L(已换算为标准状况),在此之后,又经过4 min,铁粉完全溶解。求:
(1)在前2 min内用FeCl2表示的平均反应速率;
(2)在后4 min内用HCl表示的平均反应速率;
(3)前2 min与后4 min相比,反应速率哪个较快?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com