
【题目】下列物质中,含有极性键的共价化合物是
A. H2O2 B. CH3COONa C. Na2O2 D. I2
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式中不正确的是
A. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-===SiO32-+H2O
B. 配制FeCl3溶液时要加盐酸:Fe3+ + 3H2O![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C. 燃煤时加入适量石灰石粉末,可减少SO2的排放:2CaCO3+2SO2+O2===2CaSO4+2CO2
D. 强碱溶液中,用次氯酸钠与Fe(OH)2反应制备高铁酸钠:2ClO-+Fe(OH)2===FeO42—+2Cl-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活之中有机物的种类丰富,在衣食住行等多方面应用广泛,其中乙醇、乙酸是比较常见的有机物。
(1)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为_____________________。
(2)下列关于乙醇的说法正确的是__________(选填字母)。
A 乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B 乙醇只能被氧化成乙醛
C 黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
(3)当乙酸分子中的O都是18O时,乙醇分子中的O都是16O时,二者在一定条件下反应,生成物中水的相对分子质量为____________。
(4)某有机物蒸汽在标况下的密度为3.2g/L,若该有机物的一氯代物只有一种结构,其结构简式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各原子或离子的电子排布式错误的是( )
A.Al 1s22s22p63s23p1B.O2- 1s22s22p6
C.Na+ 1s22s22p6D.Si 1s22s22p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,列出10种元素在周期表中的位置。用化学符号回答下列各题。
主族 周期 | ||||||||
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是______(元素符号)。
(2)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是____(写碱的化学式)。
(3)②③④三种元素形成的离子中,离子半径由大到小的顺序是________(用离子符号表示)。
()元素⑦的氢化物的化学式为____;该氢化物常温下和②单质反应的化学方程式是________;若该氢化物和元素⑧的单质反应,则化学方程式为___________。
(5)⑧的最高价氧化物对应水化物的化学式为__;①和⑧两元素形成化合物的电子式为___,该化合物灼烧时火焰颜色为____;①和⑨两元素形成化合物的溶液与元素⑧的单质反应的离子方程式为_____。
(6)⑤的最高价氧化物属于____氧化物(填“碱性”.“酸性”或“两性”),①和⑤元素最高价氧化物对应水化物相互反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车尾气中的主要污染物是NO、NO2和CO。用NaOH溶液可吸收NO、NO2,当n(NO)﹕n(NO2)=1时只生成一种盐,这种盐的化学式为__________。
(2)金属铬(Cr)的英文是Chromium,原意是颜色,因为它的化合物都有美丽的颜色。如表是几种常见铬的化合物或离子的水溶液的颜色:
离子或化合物 | Cr2O72- | Cr(OH)3 | Cr3+ | CrO2- | CrO42- |
颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |
含铬元素的化合物可以发生如图一系列变化:
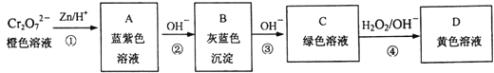
①写出反应④的离子方程式:______________________________________。
②结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
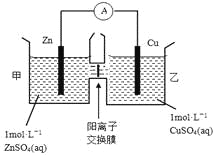
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,c(NO)随时间的变化如表:
2NO2(g)体系中,c(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
(1)分析上表,该反应达到平衡状态所需时间是_________。
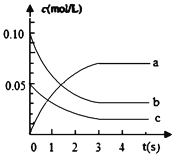
(2)上图中表示NO2的浓度变化曲线是_______________。
(3)用NO表示从0~2s内该反应的平均速率v=________。
(4)v(NO):v(O2) = ______________。
(5)达到平衡状态时O2的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com