
【题目】下表为元素周期表中的一部分,列出10种元素在周期表中的位置。用化学符号回答下列各题。
主族 周期 | ||||||||
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是______(元素符号)。
(2)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是____(写碱的化学式)。
(3)②③④三种元素形成的离子中,离子半径由大到小的顺序是________(用离子符号表示)。
()元素⑦的氢化物的化学式为____;该氢化物常温下和②单质反应的化学方程式是________;若该氢化物和元素⑧的单质反应,则化学方程式为___________。
(5)⑧的最高价氧化物对应水化物的化学式为__;①和⑧两元素形成化合物的电子式为___,该化合物灼烧时火焰颜色为____;①和⑨两元素形成化合物的溶液与元素⑧的单质反应的离子方程式为_____。
(6)⑤的最高价氧化物属于____氧化物(填“碱性”.“酸性”或“两性”),①和⑤元素最高价氧化物对应水化物相互反应的离子方程式为__________。
【答案】Ar NaOH K+>Ca2+>Mg2+ H2O 2K+2H2O=2KOH+H2↑ Cl2+H2O=HCl+HClO HClO4 ![]() 黄色 Cl2+2Br—=2Cl— +Br2 两性 Al(OH)3+OH—=AlO2— +2H2O
黄色 Cl2+2Br—=2Cl— +Br2 两性 Al(OH)3+OH—=AlO2— +2H2O
【解析】
由元素在周期表中位置可知,①为Na元素、②为K元素、③为Mg元素、④为Ca元素、⑤为Al元素、⑥为C元素、⑦为O元素、⑧为Cl元素、⑨为Br元素、⑩为Ar元素。
(1)10种元素中,稀有气体Ar原子最外层已达8电子稳定结构,化学性质最不活泼,故答案为:Ar;
(2)同周期元素从左向右,金属性依次减弱,最高价氧化物对应水化物的碱性依次减弱,Na元素、Mg元素和Al元素均为第三周期元素,则碱性最强的是NaOH,故答案为:NaOH;
(3)K+和Ca2+电子层结构相同,电子层结构相同的离子,随核电荷数增大,离子半径减小,Ca2+和Mg2+是同主族的阳离子,同主族的离子,从上到下离子半径依次增大,则K+、Ca2+、Mg2+的离子半径大小顺序为K+>Ca2+>Mg2+,故答案为:K+>Ca2+>Mg2+;
(4)元素⑦O元素,其氢化物的化学式为H2O,钾与水反应生成氢氧化钾和氢气,反应的化学方程式为2K+2H2O=2KOH+H2↑;氯气和水反应生成盐酸和次氯酸,反应的化学方程式为Cl2+H2O=HCl+HClO,故答案为:H2O;2K+2H2O=2KOH+H2↑;Cl2+H2O=HCl+HClO;
(5)⑧为Cl元素,最高价氧化物对应水化物的化学式为HClO4,钠、氯两元素形成的化合物为氯化钠,氯化钠为离子化合物,电子式为![]() ,钠元素的焰色反应为黄色;氯元素的非金属性强于溴元素,氯气和溴化钠溶液发生置换反应生成氯化钠和溴单质,反应的离子方程式为Cl2+2Br—=2Cl— +Br2,故答案为:HClO4;
,钠元素的焰色反应为黄色;氯元素的非金属性强于溴元素,氯气和溴化钠溶液发生置换反应生成氯化钠和溴单质,反应的离子方程式为Cl2+2Br—=2Cl— +Br2,故答案为:HClO4;![]() ;黄色Cl2+2Br—=2Cl— +Br2;
;黄色Cl2+2Br—=2Cl— +Br2;
(6)⑤为Al元素,最高价氧化物为氧化铝,氧化铝是两性氧化物;氢氧化铝是两性氢氧化物,与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为Al(OH)3+OH—=AlO2— +2H2O,故答案为:两性;Al(OH)3+OH—=AlO2— +2H2O。


科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
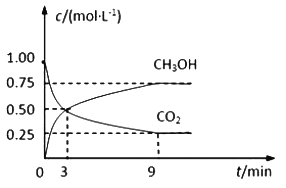
(1)从3 min到9 min,υ(H2)=________mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)平衡时CO2的转化率为______________。
(4)平衡时混合气体中CH3OH(g)的体积分数是__________________。
(5)一定温度下,第9分钟时υ逆(CH3OH) _______(填“大于”、“小于”或“等于”)第3分钟时υ正(CH3OH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法操作,能达到要求的是( )
A.用托盘天平称量25.20g氯化钠固体
B.金属钠着火燃烧时,用泡沫灭火器灭火
C.用一束强光照射经过煮沸的三氯化铁溶液有光亮的通路,说明已生成氢氧化铁胶体
D.过量的铁丝在氯气中点燃,可制取氯化亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种只含碳、氢、氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍。A可以和金属钠反应放出氢气并在一定条件下发生如图所示的变化。回答下列问题:
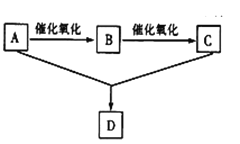
(1)A的结构简式为:__________,D的名称是___________,
(2)C中官能团名称________,A+C→D的反应类型__________,
(3)写出反应的化学方程式:
A→B_______
A+C→D_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
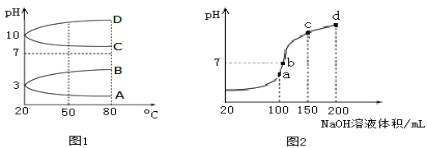
(1)如图1是几种0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是_________(填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______。
(2)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___点;在b点,溶液中各离子浓度由大到小的排列顺序是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中可能含有K+、Mg2+、Al3+、AlO、SiO、CO、SO、SO中的若干种离子。某同学对该溶液进行了如下实验:

下列判断正确的是( )
A. 气体甲一定是纯净物 B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO和SiO一定存在于溶液X中 D. CO和SO一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的主要组成元素是碳、氢、氧、硫、氮,燃煤产生CxHy、SO2等大气污染物,煤的气化是高效、清洁利用煤炭的重要途径之一。回答下列问题:
(1)利用煤的气化获得的水煤气( 主要成分为CO、CO2和H2 )在催化剂作用下可以合成绿色燃料甲醇。
已知: H2O(1) = H2O(g) ΔH1= +44 .0kJ/mol
CO2(g)+H2(g) = CO(g)+H2O(l) ΔH2=-3.0kJ/mol
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH3=-58.7 kJ/mol
写出由CO与H2制备CH3OH 气体的热化学方程式____________。
(2)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3简称DMC) ;
2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) ΔH4<0
CH3OCOOCH3(g)+H2O(g) ΔH4<0
①该化学反应的平衡常数表达式为K=__________
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是________(填编号)。
A.V正(CH3OH)= 2V逆(H2O)
B.容器内气体的密度不变
C.容器内压强不变
D.CH3OH与CO2的物质的量之比保持不变
(3)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如图所示:
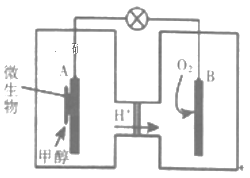
A极是_____极(填“正”或“负”),其电极反应式是_______。该电池不能在高温下工作的理由是________。
(4)一定条件下,在体积为5 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)根据题意完成下列各题:
CH3OH(g)根据题意完成下列各题:
①在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________
②在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_____
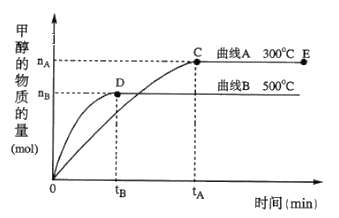
A.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加
d. 重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知自然界氧的同位素有16O、17O、18O,氢的同位素有H、D,从水分子的原子组成来看,自然界的水一共有( )
A. 3种 B. 6种 C. 9种 D. 12种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com