
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
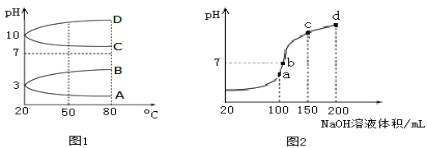
(1)如图1是几种0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是_________(填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______。
(2)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___点;在b点,溶液中各离子浓度由大到小的排列顺序是____________。
【答案】A10-3mol·L-1ac(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
【解析】
(1)①铝离子、铵根离子的水解都使溶液呈酸性,且温度升高有利于水解平衡正向移动,溶液的pH减小,酸性增强,所以A曲线符合;
②由A曲线可知室温时,0.1molL﹣1NH4Al(SO4)2的pH=3,则c(H+)=10-3mol/L,c(OH-)=10-11mol/L,根据电荷守恒2c(SO42﹣)+c(OH-)=c(NH4+)+3c(Al3+)+c(H+),所以2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-(OH-)=(10-3-10-11)mol/L≈10-3mol·L-1;
(2)水的电离程度最大时,即是水解的盐的浓度最大时,硫酸氢铵溶液中硫酸氢铵的物质的量是0.01mol,当氢离子与氢氧根离子完全反应时恰好生成硫酸铵,此时铵根离子的浓度最大,且溶液中只存在铵根离子的水解,水的电离程度最大,消耗氢氧化钠的体积是100mL,所以为a点;在b点氢离子已经完全被消耗,pH=7,溶液显中性,说明溶液中铵根的水解和一水合氨的电离程度相等,溶质是硫酸钠、硫酸铵和一水合氨,因此溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。


科目:高中化学 来源: 题型:
【题目】硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应。硼与氯气反应生成三氯化硼(BCl3),生成的三氯化硼遇水水解产生白雾(已知:BCl3的熔点为-107.3℃,沸点为12.5℃ ),且三氯化硼用于制取乙硼烷(B2H6)。某兴趣小组设计如图所示装置制备三氯化硼。
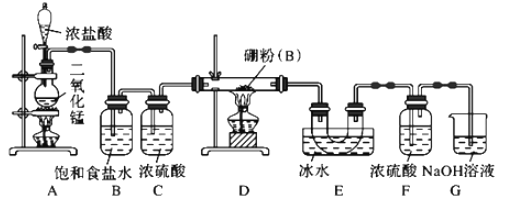
回答下列问题:
(1)装置A中发生反应的离子方程式为_____________________________。
(2)装置B中的作用是________________,装置E的作用是______________________。
(3)装置D中发生反应的化学方程式为______________________________________。
(4)装置F的作用是________________,可以用一个盛装________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晋朝人常璩在《华阳国志》里有这样一段话:临邛县“有火井,夜时光映上昭。民欲其火,先以家火投之。顷许如雷声,火焰出,通耀数十里。以竹筒盛其火藏之,可拽行终日不灭也……”,请回答下列问题。
(1)话中描述的物质是一种最简单有机物甲烷,其分子的结构式为_______。
(2)写出“顷许如雷声,火焰出”涉及的化学反应方程式:_____________________。
(3)下列有关甲烷的说法正确的是________(填选项字母)。
A.它属于化石能源
B.它的分子中含有非极性键
C.它的分子中所有原子的最外层都达到了8电子稳定结构
D.(2)中反应发生时伴随有旧极性键的断裂和新极性键的形成
(4)甲烷不仅可以直接用来燃烧,还是重要的化工原料,它可以与水在高温条件下反应制得水煤气(CO和H2),反应的化学方程式为__________________,反应得到的水煤气中CO和H2的质量比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是重要的有机合成中间体,以下是用烯烃A和羧酸D合成它的一种路线:

回答下列问题:
(1)A的结构简式为__________。
(2)B→C的反应类型为__________。该反应还能生成一种与C互为同分异构体的副产物,该副产物的结构简式为____________。
(3) D→E的化学方程式为_____________。
(4) M是H的同分异构体,写出同时满足下列条件的M的结构简式_____________。(不考虑立体异构)
①1molM与足量银氨溶液反应生成4molAg;②核磁共振氢谱为两组峰。
(5)根据上述合成路线中的信息,某学习小组设计以丙二酸二乙酯和1,2-二溴乙烷为原料合成二甲酸环己烷的流程图如下。则甲的结构简式为_______,乙的结构简式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,列出10种元素在周期表中的位置。用化学符号回答下列各题。
主族 周期 | ||||||||
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是______(元素符号)。
(2)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是____(写碱的化学式)。
(3)②③④三种元素形成的离子中,离子半径由大到小的顺序是________(用离子符号表示)。
()元素⑦的氢化物的化学式为____;该氢化物常温下和②单质反应的化学方程式是________;若该氢化物和元素⑧的单质反应,则化学方程式为___________。
(5)⑧的最高价氧化物对应水化物的化学式为__;①和⑧两元素形成化合物的电子式为___,该化合物灼烧时火焰颜色为____;①和⑨两元素形成化合物的溶液与元素⑧的单质反应的离子方程式为_____。
(6)⑤的最高价氧化物属于____氧化物(填“碱性”.“酸性”或“两性”),①和⑤元素最高价氧化物对应水化物相互反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入 0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度:a > b,且a点所示溶液中由水电离出的c(OH-)=10-8.7mol/L
C. pH=7时溶液中c(HA)>c(Na+)=c(A-)> c(H+)=c(OH-)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。

(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为____________________________________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是_____________________________________ ,已知光照条件下D与F反应生成B,写出该反应的化学方程式:______________________________________
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A. 检验试液中的SO42-![]()
B. 检验试液中的Fe2+![]()
C. 检验试液中的I-![]()
D. 检验试液中的CO32-![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com