
【题目】硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应。硼与氯气反应生成三氯化硼(BCl3),生成的三氯化硼遇水水解产生白雾(已知:BCl3的熔点为-107.3℃,沸点为12.5℃ ),且三氯化硼用于制取乙硼烷(B2H6)。某兴趣小组设计如图所示装置制备三氯化硼。
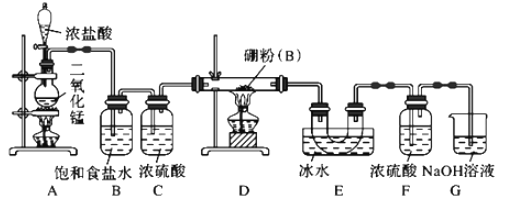
回答下列问题:
(1)装置A中发生反应的离子方程式为_____________________________。
(2)装置B中的作用是________________,装置E的作用是______________________。
(3)装置D中发生反应的化学方程式为______________________________________。
(4)装置F的作用是________________,可以用一个盛装________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去氯气中的HCl 冷却和收集三氯化硼 2B+3Cl2
Mn2++Cl2↑+2H2O 除去氯气中的HCl 冷却和收集三氯化硼 2B+3Cl2![]() 2BCl3 防止水蒸气进入装置E 碱石灰
2BCl3 防止水蒸气进入装置E 碱石灰
【解析】
实验目的是制备BCl3,实验原理是2B+3Cl2 ![]() 2BCl3,A装置制备Cl2,B装置除去HCl,C装置干燥氯气,D装置制备BCl3,E装置收集BCl3,F装置防止G中水蒸气进入E中U型管,G装置吸收多余Cl2;
2BCl3,A装置制备Cl2,B装置除去HCl,C装置干燥氯气,D装置制备BCl3,E装置收集BCl3,F装置防止G中水蒸气进入E中U型管,G装置吸收多余Cl2;
(1)A为制备Cl2的装置,其离子反应方程式为MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
(2)A中制取的氯气中混有水蒸气和HCl,因此装置B的目的是除去HCl;装置E的目的是冷却和收集BCl3;
(3)D装置是制备BCl3,其反应方程式为:2B+3Cl2 ![]() 2BCl3;
2BCl3;
(4)BCl3遇水水解,F装置中浓硫酸的作用是防止G中水蒸气进入装置E;根据F装置和G装置的作用,可以用盛有碱石灰的干燥管代替F和G。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
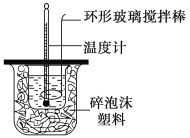
回答下列问题:
(1)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________________。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中不正确的是
A.金属性:K > Na > Li
B.热稳定性:HI > HCl > HF
C.非金属性:F> O> N
D.碱性:NaOH > Mg(OH)2 > Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是

A. X是硫元素
B. Y的最高价氧化物的电子式为 ![]()
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
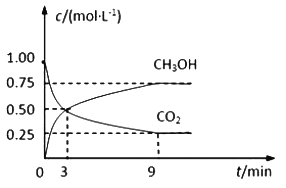
(1)从3 min到9 min,υ(H2)=________mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)平衡时CO2的转化率为______________。
(4)平衡时混合气体中CH3OH(g)的体积分数是__________________。
(5)一定温度下,第9分钟时υ逆(CH3OH) _______(填“大于”、“小于”或“等于”)第3分钟时υ正(CH3OH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,下列说法正确的是
A. CuI既是氧化产物又是还原产物
B. Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原
C. 每生成1 mol CuI,有12 mol KI发生氧化反应
D. 每转移1.1 mol电子,有0.2 mol![]() 被氧化
被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是一种常见的过氧化物,具有强氧化性和漂白性。 通常可用作漂白剂和呼吸面具中的供氧剂。
(1)某实验小组通过下列实验探究过氧化钠与水的反应:
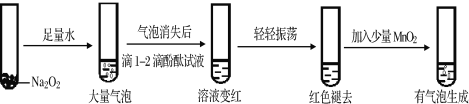
①用化学方程式解释使酚酞试液变红的原因_______________________,
依据实验现象推测红色褪去的原因是_________________。
②加入MnO2反应的化学方程式为________________________。
③ Na2O2的电子式为_____________
(2)实验小组两名同学共同设计如下装置探究过氧化钠与二氧化硫的反应。通入SO2,将带余烬的木条插入试管C中,木条复燃。
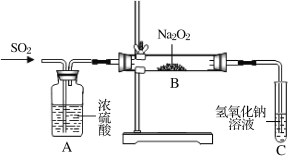
请回答下列问题:
①甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是____。
检验反应后B中的白色固体含有Na2SO3的方法是_________________。
②乙同学认为反应的后B中有Na2SO3还会有Na2SO4。乙同学猜想的理由是:_____。
为检验产物中Na2SO4的存在,乙同学设计并实施了如下实验方案:
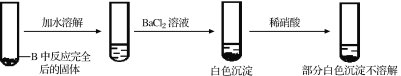
甲同学认为该实验方案的现象不能证明有Na2SO4生成,其理由为_______。
③ 测定B中反应完全后的固体中Na2SO4含量的实验方案:称取样品a 克加水溶解,_______,烘干,称量得BaSO4沉淀b 克,则Na2SO4的质量分数为____(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
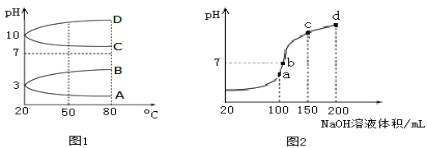
(1)如图1是几种0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是_________(填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______。
(2)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___点;在b点,溶液中各离子浓度由大到小的排列顺序是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com