
【题目】KMnO4是实验室中常用的一种试剂。回答下列问题:
(1)K+的结构示意图为___。
(2)在酸性高锰酸钾溶液中滴加过量的草酸(H2C2O4,弱酸)溶液,振荡,溶液紫色变无色。发生的化学反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,若将该反应设计成原电池,则负极反应式为___。
(3)在10mL0.1mol·L-1KMnO4溶液(含稀硫酸)中加入15mL0.5mol.L-1草酸溶液,收集到的CO2的量与时间的关系如图所示。

AB段反应速率增大的原因可能是___(填字母)。
a.该反应是放热反应
b.反应物浓度增大
c.K2SO4起催化作用
d.MnSO4起催化作用
(4)为了探究外界条件对化学反应速率的影响,设计如下方案:
实验 | 0.1mol·L-1KMnO4/mL | 0.5mol·L-1H2C2O4/mL | 0.1mol·L-1H2SO4/mL | 水浴 温度/℃ | 蒸馏水 /mL | 褪色时间 /min |
I | 5.0 | 15.0 | 5.0 | 35 | 0 | t1 |
II | 5.0 | 10.0 | 5.0 | 35 | V | t2 |
III | 5.0 | 15.0 | 3.0 | 35 | 2.0 | t3 |
IV | 5.0 | 15.0 | 5.0 | 45 | 0 | t4 |
①V=___。
②该实验方案不能探究对反应速率有影响的因素是___。
A.浓度 B.酸度 C.温度 D.催化剂
③若测得结果:t4<t1,则实验结论是___。
【答案】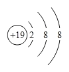 H2C2O4-2e-=2CO2↑+2H+ a、d 5.0 D 其他条件不变,升温,化学反应速率增大
H2C2O4-2e-=2CO2↑+2H+ a、d 5.0 D 其他条件不变,升温,化学反应速率增大
【解析】
(1)K为19号元素,原子核外有19个电子,失去一个电子形成K+,所以K+的结构示意图为 ;
;
(2)原电池中负极失电子发生氧化反应,根据总反应可知反应过程中草酸被氧化成二氧化碳,所以负极反应为H2C2O4-2e-=2CO2↑+2H+;
(3)a.该反应为放热反应,随反应进行放出热量使反应体系温度升高,反应速率加快,故a合理;
b.随反应进行反应不断被消耗,反应物浓度减小,故b不合理;
c.若K2SO4起催化作用则反应开始到结束K2SO4的物质的量并没有变化,反应速率不应该一直增大,故c不合理;
d.随反应进行,溶液中MnSO4逐渐增大,催化作用增加,速率一直加快,故d合理;
综上所述选ad;
(4)①控制变量法探究实验中每组实验的变量应只有一个,所以II组实验中溶液的总体积应与第I组相等,即5.0+10.0+5.0+V=5.0+15.0+5.0,解得V=5.0mL;
②第I和II组实验变量为草酸的浓度,对比两组实验可以探究浓度对反应速率的影响;第I和III组实验变量为硫酸的用量,对比两组实验可以探究酸度对反应速率的影响;第I和IV组实验变量为温度,对比两组实验可以探究温度对反应速率的影响;没有哪两组实验的变量为催化剂,所以不能探究催化剂对反应速率的影响,所以选D;
③第I和IV组实验变量为温度,测得结果:t4<t1,说明其他条件不变,升温,化学反应速率增大。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向50 mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如下图所示。下列说法正确的是

A. 若a点pH=4,且c(Cl-)=m·c(ClO-),则Ka(HClO)=![]()
B. 若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH
C. b~c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
D. 若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯分子中不存在碳碳单键、碳碳双键的交替结构,下列可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯不能因发生化学反应而使溴的四氯化碳溶液褪色
③苯在加热和有催化剂存在的条件下能与H2加成生成环己烷
④苯分子中碳碳键的键长完全相等
⑤邻二氯苯(![]() )只有一种
)只有一种
⑥间二氯苯(![]() )只有一种
)只有一种
A.①②B.①⑤C.③④⑤⑥D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰电池的总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。下列有关说法错误的是( )
A.锌为负极材料
B.该电解质溶液可能是稀硫酸
C.正极反应式为MnO2+H2O+e-=MnOOH+OH-
D.消耗13g锌时电路中转移电子的物质的量为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中导电性最强的是( )
A. 1 L 0.1 mol/L AlCl3溶液 B. 0.1 L 0.1 mol/L H2SO4溶液
C. 0.5 L 0.15 mol/L盐酸 D. 2 L 0.1 mol/L H2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气及许多含氯化合物是生产、生活中应用非常广泛的物质。磺酰氯(SO2Cl2)是实验室中常见试剂。已知:SO2Cl2(g)![]() SO2(g)+Cl2(g)
SO2(g)+Cl2(g)
(1)在2 L恒容密闭耐腐蚀性的容器中充入0.1 mol SO2Cl2(g)发生反应,在101 kPa、375K条件下进行该反应,SO2Cl2的转化率与时间关系如图所示。
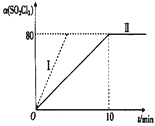
①平衡时,容器内压强p=_________________。
②相对曲线Ⅱ对应实验,仅改变一个条件得到曲线I,曲线I改变的条件可能是_____________________。
(2)一定量氯气用饱和纯碱溶液吸收恰好只生成三种盐(不产生气体),该溶液中阴离子浓度大小顺序为______________________________________________________。
(3)已知:常温下,次氯酸(HClO)的电离常数Ka=2.5×10-8,则在该温度下,NaClO水解反应的水解常数Kh为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是燃料(如氢气、甲烷、一氧化碳等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液。下面关于甲烷燃料电池的说法正确的是( )
A. 负极反应式:O2+2H2O+4e-![]() 4OH-
4OH-
B. 负极反应式:CH4+8OH--8e-![]() CO2+6H2O
CO2+6H2O
C. 随着放电的进行,溶液中氢氧根离子的浓度不变
D. 放电时溶液中的阴离子向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HC1溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是
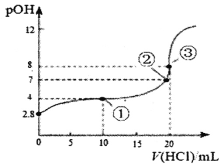
A. 图中②点所示溶液的导电能力弱于①点
B. ③点处水电离出的c(H+)=1×10-8mol·L-1
C. 图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+)
D. 25℃时氨水的Kb约为5×10-5.6mo1·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X) < Mr(Y)= 0.5Mr(Z),下列说法正确的是()
A.原子数目相等的三种气体,质量最大的是Z
B.相同条件下,同质量的三种气体,气体密度最小的是X
C.若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D.同温下,体积相同的两容器分别充2gY气体和1gZ气体,则其压强比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com