
【题目】氯气及许多含氯化合物是生产、生活中应用非常广泛的物质。磺酰氯(SO2Cl2)是实验室中常见试剂。已知:SO2Cl2(g)![]() SO2(g)+Cl2(g)
SO2(g)+Cl2(g)
(1)在2 L恒容密闭耐腐蚀性的容器中充入0.1 mol SO2Cl2(g)发生反应,在101 kPa、375K条件下进行该反应,SO2Cl2的转化率与时间关系如图所示。
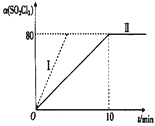
①平衡时,容器内压强p=_________________。
②相对曲线Ⅱ对应实验,仅改变一个条件得到曲线I,曲线I改变的条件可能是_____________________。
(2)一定量氯气用饱和纯碱溶液吸收恰好只生成三种盐(不产生气体),该溶液中阴离子浓度大小顺序为______________________________________________________。
(3)已知:常温下,次氯酸(HClO)的电离常数Ka=2.5×10-8,则在该温度下,NaClO水解反应的水解常数Kh为______________________________。
【答案】181.8 kPa 加入催化剂 c(HCO3-)>c(Cl-)>c(ClO-)>c(OH-)>c(CO32-) 4.0×10-7
【解析】
根据化学反应方程式,分析反应初始状态、平衡状态时各物质的物质的量的变化,进而进行物质的量计算;根据图像已知信息分析解答;根据盐类的水解原理分析解答。
(1) ① SO2Cl2(g)![]() SO2(g)+Cl2(g)
SO2(g)+Cl2(g)
初始 0.1mol 0 0
平衡时反应了0.1mol×80% 0.08mol 0.08mol
平衡时容器
中剩余 0.02mol 0.08mol 0.08mol
体积不变的容器中,压强之比等于物质的量之比,所以得到![]() ,P=181.8 kPa;
,P=181.8 kPa;
故答案为:181.8 kPa;
②从图像中可知,曲线Ⅱ与曲线I平衡时的转化率相同,只是反应达到平衡的时间减少,即加快了化学反应速率,所以曲线I的反应中是加入了催化剂;
故答案为:加入催化剂;
(2)氯气与碳酸钠溶液反应离子方程式为:Cl2 +2CO32- + H2O=Cl- + ClO- + 2HCO3-,从化学计量数上可以判断出c(HCO3-)最大,c(CO32-)最小,ClO-会发生水解,所以c(Cl-)> c(ClO-),该溶液中阴离子浓度大小顺序为:c(HCO3-)>c(Cl-)>c(ClO-)>c(OH-)>c(CO32-);
故答案为:c(HCO3-)>c(Cl-)>c(ClO-)>c(OH-)>c(CO32-);
(3)根据公式Kh=![]() =
=![]() =4.0×10-7;
=4.0×10-7;
故答案为:4.0×10-7。


科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系正确的是
A. 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液
B. 氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂
C. 碳酸钠溶液具有碱性,可用于治疗胃酸过多
D. 氯化铁溶液呈酸性,可用于蚀刻铜电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
下列说法正确的是

A. H2转化率:a>b>c
B. 上述三种温度之间关系为T1>T2>T3
C. a点状态下再通入0.5 mol CO和0.5 molCH3OH,平衡不移动
D. c点状态下再通入1 molCO和4 mol H2,新平衡中H2的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期主族元素在周期表中的相对位置如图所示。已知A的最高正化合价和最低负化合价代数和等于0。回答下列问题:

(1)元素E在周期表中的位置是___。
(2)BD3分子的电子式为___。
(3)在元素B、C、D、E的气态氢化物中,稳定性最强的是___ (填化学式)。
(4)设计简单实验证明元素D的非金属性比元素C的强:___。
(5)写出一种满足下列条件的A的氢化物的结构简式___ (不考虑立体异构)。
①分子中含有6个A原子
②能使溴水褪色
③一氯代物只有一种结构
④不含环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是实验室中常用的一种试剂。回答下列问题:
(1)K+的结构示意图为___。
(2)在酸性高锰酸钾溶液中滴加过量的草酸(H2C2O4,弱酸)溶液,振荡,溶液紫色变无色。发生的化学反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,若将该反应设计成原电池,则负极反应式为___。
(3)在10mL0.1mol·L-1KMnO4溶液(含稀硫酸)中加入15mL0.5mol.L-1草酸溶液,收集到的CO2的量与时间的关系如图所示。

AB段反应速率增大的原因可能是___(填字母)。
a.该反应是放热反应
b.反应物浓度增大
c.K2SO4起催化作用
d.MnSO4起催化作用
(4)为了探究外界条件对化学反应速率的影响,设计如下方案:
实验 | 0.1mol·L-1KMnO4/mL | 0.5mol·L-1H2C2O4/mL | 0.1mol·L-1H2SO4/mL | 水浴 温度/℃ | 蒸馏水 /mL | 褪色时间 /min |
I | 5.0 | 15.0 | 5.0 | 35 | 0 | t1 |
II | 5.0 | 10.0 | 5.0 | 35 | V | t2 |
III | 5.0 | 15.0 | 3.0 | 35 | 2.0 | t3 |
IV | 5.0 | 15.0 | 5.0 | 45 | 0 | t4 |
①V=___。
②该实验方案不能探究对反应速率有影响的因素是___。
A.浓度 B.酸度 C.温度 D.催化剂
③若测得结果:t4<t1,则实验结论是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的分子式是C6H8O4,关于该分子的结构推测合理的是
A. 可能含有1个苯环
B. 可能含有两个碳碳三键和4个羟基
C. 可能含有2个羧基和1个碳碳双键
D. 可能含有1个醛基、1个羧基、1个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福莫特罗是一种治疗哮喘病的药物,它的关键中间体(G)的合成路线如下:

回答下列问题:
(1)F的分子式为_____________,反应①的反应类型为_________。
(2)反应④的化学方程式为___________________________。
(3)C能与FeC13 溶液发生显色反应,C的结构简式为________________, D中的含氧官能团为_________________。
(4)B的同分异构体(不含立体异构)中能同时满足下列条件的共有_____种。
a.能发生银镜反应 b.能与NaOH溶液发生反应 c.含有苯环结构
其中核磁共振氢谱显示为4组峰,且峰面积比为3:2:2:1的是________________(填结构简式)。
(5)参照G的合成路线,设计一种以![]() 为起始原料(无机试剂任选)制备的
为起始原料(无机试剂任选)制备的![]() 合成路线________。
合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成。若准确称取0.44g某有机物样品,经充分燃烧后,依次通入浓硫酸和碱石灰,分别增重0.36g、0.88g.
(1)求该有机物的实验式为___________
(2)已知其蒸气密度为同条件下H2的22倍,该有机物的分子式为___________
(3)该有机物的核磁共振氢谱中有2个峰,峰面积之比为1:3,其结构简式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试管内完全充满液体,原来试管中盛装的气体是( )
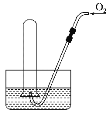
A.可能是N2和NO2的混合气体
B.一定是NO2气体
C.可能是NO与NO2的混合气体
D.只可能是NO2一种气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com