
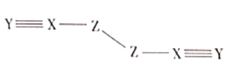
【题目】X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物![]() 的结构式如图所示。下列说法错误的是( )
的结构式如图所示。下列说法错误的是( )
A.Z与W形成的化合物熔点高
B.Y与Z能形成多种化合物
C.X的氢化物的沸点一定小于Z的氢化物
D.化合物![]() 中所有原子均满足8电子稳定结构
中所有原子均满足8电子稳定结构
【答案】C
【解析】
由(ZXY)2的结构可知,X能够形成四条共价键,Y能够形成三条共价键,Z能够形成两条共价键;此外,W的原子序数比X大,且W的最外层电子数比X的小1;因此推测X为C元素,那么Y为N元素,Z为O元素,W则为Al元素。
A.通过分析可知,Z与W形成的化合物即氧化铝,氧化铝熔点很高,可用作耐高温材料,A项正确;
B.通过分析可知,Y为N元素,Z为O元素;氮的氧化物有多种如NO,NO2,N2O4等,B项正确;
C.通过分析可知,Z为O元素,其氢化物为水或过氧化氢;X为C元素,烃类都可认为是其氢化物,有的沸点低有的沸点高;因此X的氢化物沸点不一定小于Z的氢化物,C项错误;
D.通过分析可知,(ZXY)2即(OCN)2,由其结构可知,分子中C、N。O都达到了8电子稳定结构,D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】已知1mol H2完全燃烧生成水蒸气放出热量242kJ,且H2中1mol H-H键断裂时吸收热量436kJ,水蒸气中形成1mol H-O键时放出热量463 kJ,则O2中1mol O=O键断裂时吸收的热量为
A.556 kJB.496 kJC.336 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,容积不变的容器里,对可逆反应A(g) ![]() 2B(g) +3C(g)的叙述中,能说明反应已达到平衡的是
2B(g) +3C(g)的叙述中,能说明反应已达到平衡的是
A.混合气体的物质的量不再变化B.单位时间消耗a mol A, 同时生成3a molC
C.容器内的气体总质量不再变化D.C生成的速率与B分解的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不是氧化还原反应的是( )
A.3Cl2+6KOH=5KCl+KClO3+3H2O
B.CuO+H2![]() Cu+H2O
Cu+H2O
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
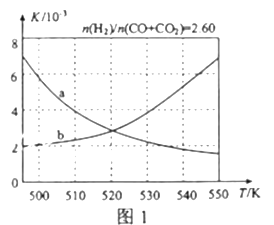
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据粗盐提纯的原理,除去氯化钾溶液中少量的氯化镁、硫酸镁等杂质,可选用氢氧化钡溶液、稀盐酸和碳酸钾溶液三种试剂,按如图步骤操作:
![]()
(1)A的化学式是__________,B的化学式是________,C的化学式是__________。
(2)加入过量A的目的是__________________。
(3)加入过量B的目的是____________________。
(4)加热煮沸的目的是________________________。
(5)操作Ⅰ的名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 按系统命名法, ![]() 的名称为2,6二甲基5乙基庚烷
的名称为2,6二甲基5乙基庚烷
B. 丙氨酸和甘氨酸脱水,最多可生成4种二肽
C. 化合物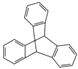 是芳香族化合物
是芳香族化合物
D. 三硝酸甘油酯的分子式为C3H5N3O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向足量的硫酸溶液中加入200mL 0.4mol/L 的Ba(OH)2溶液,放出10.24kJ的热量。向足量的Ba(OH)2溶液中加入200mL 0.4mol/L 的HCl溶液,放出2.2kJ的热量。则硫酸钠溶液和氯化钡溶液反应的离子的热化学方程式为
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -2.92 kJ/mol
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -18 kJ/mol
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -0.72 kJ/mol
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -73 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
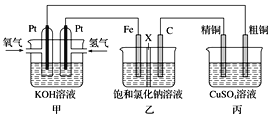
(1)通入氢气的电极为________ (填正极或负极),该电极反应式为________。
(2)石墨电极为________ (填阳极或阴极),乙中总反应化学方程式为________;如果把铁电极和石墨电极交换,乙溶液左侧出现的现象是_________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01mol O2,丙中精铜增重_________克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com