
����Ŀ��ijͬѧ���һ��ȼ�ϵ��(����ͼ��ʾ)��Ŀ����̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ��
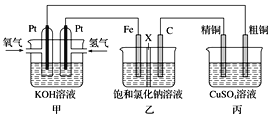
��1��ͨ�������ĵ缫Ϊ________ (��������)���õ缫��ӦʽΪ________��
��2��ʯī�缫Ϊ________ (������������)�������ܷ�Ӧ��ѧ����ʽΪ________����������缫��ʯī�缫����������Һ�����ֵ�������_________��
��3�������ͭ�к���п���������ʣ���װ���з�Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ�__________(�������С�����䡱)��
��4������������0.01mol O2�����о�ͭ����_________�ˡ�
���𰸡����� H2-2e-+2OH-=2H2O ���� 2NaCl+2H2O![]() 2NaOH+H2��+Cl2�� ��Һ���������ݳ������������ɫ������Ȼ���ɫ����Ѹ��ת��Ϊ����ɫ�����ת��Ϊ���ɫ�� ��С 1.28g
2NaOH+H2��+Cl2�� ��Һ���������ݳ������������ɫ������Ȼ���ɫ����Ѹ��ת��Ϊ����ɫ�����ת��Ϊ���ɫ�� ��С 1.28g
��������
��ͼ�п��Կ������׳�Ϊԭ���(����Դ)���ҳ�Ϊ���أ�����Ϊͭ�ĵ�⾫�����׳��У�ͨ�����ĵ缫Ϊ������ͨ�����ĵ缫Ϊ�������ҳ��У�Fe�缫Ϊ������C�缫Ϊ�����������У���ͭΪ��������ͭΪ������
(1)ͨ�������ĵ缫Ϊ�����������ĵ缫��ӦʽΪ��H2-2e-+2OH-=2H2O����Ϊ������H2-2e-+2OH-=2H2O��
(2)ʯī�缫Ϊ�����������ܷ�Ӧ��ѧ����ʽΪ��2NaCl+2H2O![]() 2NaOH+H2��+Cl2������������缫��ʯī�缫����������Һ�Ҳ���ķ�ӦΪFe-2e-=Fe2+��ͨ�������ӽ���Ĥ�����ҳص���࣬���ҳص���࣬�����ķ�ӦΪ2H2O+2e-=2OH-+H2����Fe2++2OH-=Fe(OH)2����4Fe(OH)2+O2+2H2O=4Fe(OH)3�������ҳ������ֵ������ǣ���Һ���������ݳ������������ɫ������Ȼ���ɫ����Ѹ��ת��Ϊ����ɫ�����ת��Ϊ���ɫ����Ϊ������2NaCl+2H2O
2NaOH+H2��+Cl2������������缫��ʯī�缫����������Һ�Ҳ���ķ�ӦΪFe-2e-=Fe2+��ͨ�������ӽ���Ĥ�����ҳص���࣬���ҳص���࣬�����ķ�ӦΪ2H2O+2e-=2OH-+H2����Fe2++2OH-=Fe(OH)2����4Fe(OH)2+O2+2H2O=4Fe(OH)3�������ҳ������ֵ������ǣ���Һ���������ݳ������������ɫ������Ȼ���ɫ����Ѹ��ת��Ϊ����ɫ�����ת��Ϊ���ɫ����Ϊ������2NaCl+2H2O![]() 2NaOH+H2��+Cl2������Һ���������ݳ������������ɫ������Ȼ���ɫ����Ѹ��ת��Ϊ����ɫ�����ת��Ϊ���ɫ��
2NaOH+H2��+Cl2������Һ���������ݳ������������ɫ������Ȼ���ɫ����Ѹ��ת��Ϊ����ɫ�����ת��Ϊ���ɫ��
(3)�����ͭ�к���п���������ʣ���װ���з����ķ�ӦΪ:������Zn-2e-=Zn2+��Cu-2e-=Cu2+��������Cu2++2e-=Cu����Ϊ��·��ͨ�����ӵ����ʵ�����ȣ��������ŵ�ⷴӦ�Ľ��У���Һ��Cu2+���ϼ�С����Ϊ��С��
(4)��ͨ�������غ㽨�����¹�ϵʽ
O2����4e-����2Cu
0.01mol 0.02mol
![]() ��
��
��Ϊ1.28g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W������ԭ��������������Ķ�����Ԫ�أ�W��������������X��������������1����X��Y��ZΪͬһ����Ԫ�أ�X��Y��Z���һ�ֻ�����![]() �Ľṹʽ��ͼ��ʾ������˵��������ǣ� ��
�Ľṹʽ��ͼ��ʾ������˵��������ǣ� ��
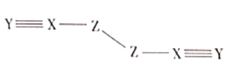
A.Z��W�γɵĻ������۵��
B.Y��Z���γɶ��ֻ�����
C.X���⻯��ķе�һ��С��Z���⻯��
D.������![]() ������ԭ�Ӿ�����8�����ȶ��ṹ
������ԭ�Ӿ�����8�����ȶ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ƽ��״̬�ķ�Ӧ��2X(s)��Y(g)![]() 2Z(g) ��HС��0��Ϊ��ʹƽ��������Z�ķ����ƶ���Ӧѡ��������ǣ� ��
2Z(g) ��HС��0��Ϊ��ʹƽ��������Z�ķ����ƶ���Ӧѡ��������ǣ� ��
�������¶� �ڽ����¶� ������ѹǿ �ܽ���ѹǿ �ݼ��������� �����Z
A.�٢ۢ�B.�ڢۢ�C.�ڢۢ�D.�ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ�����ӷ���ʽ����ȷ����(����)
A.��Ƭ����NaOH��Һ�������������2Al+2OH��+2H2O=2AlO2+3H2��
B.��K2Cr2O7��Һ�еμ�����ŨH2SO4����Һ��ɫ���Cr2O72(��ɫ)+H2O2CrO42(��ɫ)+2H+
C.��Na2SiO3��Һ��ͨ�����CO2�Ʊ�����������SiO32- +CO2+H2O=H2SiO3(����)+ CO32-
D.��Na2CO3��Һ���ݹ�¯ˮ��(��CaSO4)��CaSO4+CO32-![]() CaCO3+SO42-
CaCO3+SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������缫������KOH��Һ�У�Ȼ��ֱ�������ͨ��CH4��O2����������������Ϊ����ȼ�ϵ�ء���֪����ȼ�ϵ�������缫�ϵķ�Ӧ�ֱ�ΪCH4��8e-��10OH-=CO32-��7H2O��2O2��8e-��4H2O=8OH-�������й�˵���д�����ǣ� ��
A.CH4�ڸ����Ϸ�Ӧ��O2�������Ϸ�Ӧ
B.�ŵ�����е������Һ�ļ��Լ���
C.�˵�����ڻ����Ѻ��͵��
D.�˵���л�ѧ��100%ת��Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú���ҹ���Ҫ�Ļ�ʯȼ�ϣ�ú������ҵ�в�����H2SҲ��һ����Ҫ�Ĺ�ҵ��Դ��
(1)úҺ����_____(����������������ѧ��)�仯���̡�
(2)úҺ�������в�����H2S���������ᣬ���ֹ�����ͼ��ʾ��
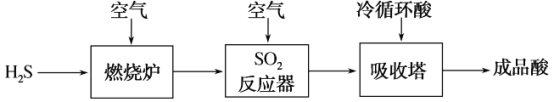
��SO2��Ӧ���еĻ�ѧ����ʽ��_____��
�����������е�β����Ҫ�ⶨSO2�ĺ������ϱ������ŷţ���֪��V L(�ѻ���ɱ�״��)β����ͨ������H2O2�����ټ�����BaCl2��Һ��ַ�Ӧ��(������β���������ɷֵķ�Ӧ)�����ˡ�ϴ�ӡ���������õ�b g������β����SO2�ĺ���(�������)�ļ���ʽ��_____��
(3)H2S�������ڻ��յ�������H2S�Ϳ�����β����һ������ͨ������FeCl3��Һ����ʵ�ֿ������õ�������FeCl3��Һ����H2S�����У���Һ�е�n(Fe3+)�������յ�n(H2S) ��ʱ��t�ı仯��ͼ��
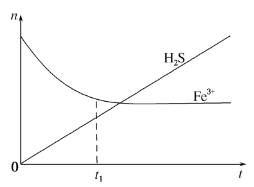
����ͼ����Ϣ��֪��0��t1ʱ��һ�������ķ�Ӧ��_____(�����ӷ���ʽ��ʾ)��
��t1�Ժ���Һ��n(Fe3+)���ֻ������䣬ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���a mol N2��b mol H2�Ļ������ͨ��һ���ݻ����ܱ������У��������·�Ӧ��N2��g��+3H2��g��![]() 2NH3��g��
2NH3��g��
��1������Ӧ���е�ijʱ��tʱ��n��N2��=13mol��n��NH3��=6mol��
����a=_______��
��2����Ӧ�ﵽƽ��ʱ�������������Ϊ716.8L����״���£�������NH3�İٷֺ��������������Ϊ25%�����㣺ƽ��ʱNH3�����ʵ���Ϊ_____________��
��3��ԭ���������ƽ��������������ʵ���֮��
n��ʼ��: n��ƽ��=____________��
��4��ԭ���������a : b=_______________��
��5���ﵽƽ��ʱ��N2��H2��ת����![]() ��N2��:
��N2��:![]() ��H2��=______________��
��H2��=______________��
��6��ƽ����������n��N2��: n��H2��: n��NH3��=______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С�鹫˾������Li-SO2Cl2���õ�أ���ʾ��ͼ��ͼ��ʾ����֪����ܷ�ӦΪ��2Li+ SO2Cl2= 2LiCl+SO2�������������д�����ǣ� ��
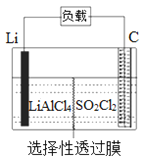
A. ��ع���ʱ����������Li������������Ӧ
B. ��ع���ʱ��������﮵缫��������������̼��
C. ��ع��������У�ʯī�缫��ӦʽΪSO2Cl2+2e-=2Cl-+SO2��
D. ��ع���ʱ�����·����0.2 mol���ӣ�����2.24 L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����Թž�����ҩ�Ƶ�ϰ�ߡ�ҩ�ƶ�ѡ��50-60�ȵİƣ�����ҩ�Ľ����ھ��У�����һ��ʱ�䣬��ҩ���е���Ч�ɷ֣���Ҫ���л���ܽ��ھ��У���ʱ���ɹ���ȥ�������á���ҩ�Ƶ�ԭ������

A.��ȡB.�ᾧC.����D.�û�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com