
| A、氧化物、化合物 |
| B、化合物、非电解质 |
| C、溶液、胶体 |
| D、溶液、分散系 |


科目:高中化学 来源: 题型:
| A、胶体的分散质粒子直径在1 nm~100nm之间 |
| B、胶体粒子有吸附性 |
| C、胶体粒子不能穿过半透膜,能通过滤纸空隙 |
| D、胶体粒子能够产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤ | B、③④ |
| C、②④⑥ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NaH中氢离子结构示意图为: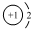 | ||||
B、NH4I的电子式: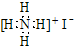 | ||||
C、质子数是82,中子数是122的铅原子:
| ||||
D、CO2的比例模型: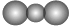 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、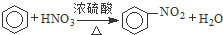 ;取代反应 ;取代反应 | ||
| B、CH2=CH2+Br2→CH2Br-CH2Br;加成反应 | ||
C、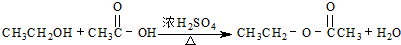 ;酯化反应 ;酯化反应 | ||
D、CH4+Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3h):
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3h):| T/K | 303 | 313 | 323 | 353 |
| NH3生成量 /10-6 mol | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
| 4 |
| 7 |
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
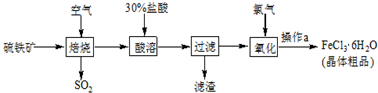
| 压强/KPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com