
| 压强/KPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
| ||
| ||
| 120×1×104t×98% |
| 196×80%×90% |


科目:高中化学 来源: 题型:
| A、2Na+2H2O═2NaOH+H2↑ |
| B、2F2+2H2O═4HF+O2↑ |
| C、SO2+H2O═H2SO3 |
| D、Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n(Ca2+)增大 |
| B、c(Ca2+)减小 |
| C、pH增大 |
| D、c(OH-)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| W(CaO)/% NaOH浓度/% 浸出率/% 碱用量c/(mol.L-1) | 0.1 | 1.3 | 1.3 | 2.7 |
| 30 | 30 | 40 | 40 | |
| 1.1 | 99.1 | 90.1 | 93.3 | 83.2 |
| 1.3 | 99.4 | 92.7 | 93.0 | 82.1 |
| 1.5 | 99.5 | 93.4 | 96.5 | 83.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 1molC单质能与冷水反应,在标准状况下生成11.2LH2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与Ar原子相同 |
查看答案和解析>>
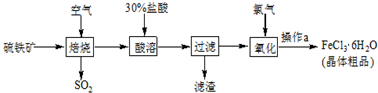
科目:高中化学 来源: 题型:
查看答案和解析>>
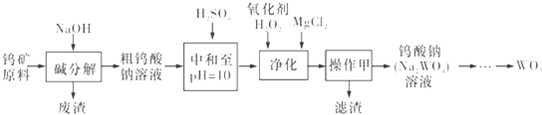
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com