
| A、n(Ca2+)增大 |
| B、c(Ca2+)减小 |
| C、pH增大 |
| D、c(OH-)不变 |


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
| A、1mol苯分子中含有碳碳双键的数目为3NA |
| B、2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA |
| C、1mol-OH中电子数目为10NA |
| D、标准状况下,2.24 L溴乙烷中含共价键数目为0.7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、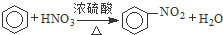 ;取代反应 ;取代反应 | ||
| B、CH2=CH2+Br2→CH2Br-CH2Br;加成反应 | ||
C、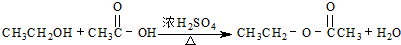 ;酯化反应 ;酯化反应 | ||
D、CH4+Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3h):
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3h):| T/K | 303 | 313 | 323 | 353 |
| NH3生成量 /10-6 mol | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
| 4 |
| 7 |
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
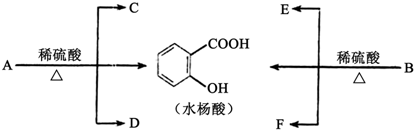
查看答案和解析>>
科目:高中化学 来源: 题型:
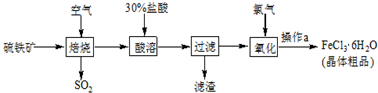
| 压强/KPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 操作 | 现象 |
| I | 向2mL 1mol?L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色. |
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
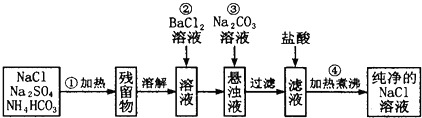
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com