
【题目】N、Cu及其相关化合物用途非常广泛。回答下列问题:
(1)基态铜原子的价电子排布式为__________________。
(2)NH3分子的立体构型为_________,中心原子的杂化类型是_________。
(3)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是_________,电负性最小的是_________。(填元素符号)
(4)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为_________(填“离子晶体”或“分子晶体”,下同),CuCl为_________。
(5)氮与铜形成的一种化合物的晶胞结构如图所示。

与每个Cu原子紧邻的Cu原子有_________个,阿伏加德罗常数的数值为NA,该晶体的密度为_________(列出计算式)g·cm-3。
【答案】3d104s1 三角锥形 sp3 N P 离子晶体 分子晶体 8 ![]()
【解析】
(1)铜是29号元素,基态铜原子的价电子排布式为3d104s1。
(2)NH3中N价层电子对数=3+![]() =4,孤对电子数为1,N原子的杂化类型是sp3。
=4,孤对电子数为1,N原子的杂化类型是sp3。
(3)N原子2p轨道处于半充满状态,能量低,故第一电离能最大,同周期随着原子序数增大电负性增大,同主族自上而下电负性减小。
(4)根据熔点大小可判断。
(5)根据均摊法计算。
(1)铜是29号元素,基态铜原子的价电子排布式为3d104s1。故答案为:3d104s1;
(2)NH3中N价层电子对数=3+![]() =4,孤对电子数为1,中心原子的杂化类型是sp3,NH3分子的立体构型为三角锥形。故答案为:三角锥形;sp3;
=4,孤对电子数为1,中心原子的杂化类型是sp3,NH3分子的立体构型为三角锥形。故答案为:三角锥形;sp3;
(3)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能N>P>S,原因是N原子2p轨道处于半充满状态,能量低,三种元素中第一电离能最大的是N,同周期随着原子序数增大电负性增大,同主族自上而下电负性减小,电负性N>S>P,电负性最小的是P。(填元素符号),故答案为:N;P;
(4)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,根据熔点大小可判断Cu2O为离子晶体,CuCl为分子晶体。故答案为:离子晶体;分子晶体;
(5)Cu原子都在棱上,与每个Cu原子紧邻的Cu原子有8个,在立方晶胞中,顶点粒子占![]() ,棱上粒子占
,棱上粒子占![]() ,因此一个晶胞中,Cu的数目为3,N的数目为1,该晶体的化学式为Cu3N,Cu3N的摩尔质量为206g·mol-1,1nm=10-9m=10-7cm,密度=
,因此一个晶胞中,Cu的数目为3,N的数目为1,该晶体的化学式为Cu3N,Cu3N的摩尔质量为206g·mol-1,1nm=10-9m=10-7cm,密度=![]() =
=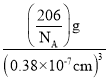 ,该晶体的密度为
,该晶体的密度为![]() g·cm-3。故答案为:8;
g·cm-3。故答案为:8;![]() 。
。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】对含微量![]() 的某样品进行
的某样品进行![]() 化学定量测定,有以下两种途径,最后均是以淀粉作指示剂,用
化学定量测定,有以下两种途径,最后均是以淀粉作指示剂,用![]() 标准溶液滴定以求得
标准溶液滴定以求得![]() 的浓度。下列分析正确的是
的浓度。下列分析正确的是
已知:![]() 过量
过量![]()
方法一![]() 样品
样品![]()
![]()
![]() -
-![]()
![]()
![]()
![]()
![]()
方法二![]() 样品
样品![]()
![]() I2
I2![]()
![]()
A.方法二对样品所做处理操作简便,用作微量的测定更准确
B.当待测液由无色变为蓝色时即达到滴定终点
C.方法一与方法二测量出的样品浓度比为6:l
D.假设各步骤操作均得当,方法一所消耗![]() 标准溶液的体积是方法二的6倍
标准溶液的体积是方法二的6倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】任意两个环共用两不直接相连的碳原子的环烃称为桥环化合物。金刚烷就是其中的一种,其结构如图示。下列关于该化合物的说法错误的是
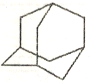
A. 与癸烷互为同分异构体B. 二氯代物超过3种
C. 分子结构中不含甲基D. 结构中含有2个以上6元环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹,下列与实验事实相符的是
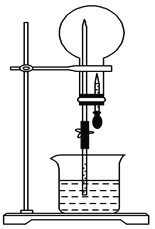
A. NH3(H2O含紫色石蕊试液),红色喷泉
B. SO2(NaOH溶液),无色喷泉
C. HCl(H2O含紫色石蕊试液),蓝色喷泉
D. NO(NaOH溶液),无色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:

试回答下列问题:
(1)请写出C装置中生成CH2Cl2的化学方程式:_________________________________。
有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法___________(填“正确”或“不正确”)。
(2)B装置有三种功能:①混匀混合气体;②___________;③___________。
(3)D装置的名称为___________,其作用是___________。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为___________(填字母)。
a.分液法 b.蒸馏法 c.结晶法
(5)将1mol CH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为___________,生成HCl的总物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.量取![]() 溶液用碱式滴定管量取
溶液用碱式滴定管量取
B.为测定新制氯水的 pH,用玻璃棒蘸取液体滴在 pH试纸上,与标准比色卡对照即可
C.探究催化剂对![]() 分解速率的影响:在相同条件下,向一支试管中加入
分解速率的影响:在相同条件下,向一支试管中加入![]() 和
和![]() ,向另一支试管中加入
,向另一支试管中加入![]() 和
和![]() 溶液,观察并比较实验现象
溶液,观察并比较实验现象
D.已知 ![]() ,为了利用该反应探究反应速率与温度的关系,所用试剂除
,为了利用该反应探究反应速率与温度的关系,所用试剂除![]() 溶液、
溶液、![]() 稀硫酸外,还需要用到淀粉溶液
稀硫酸外,还需要用到淀粉溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com