
【题目】氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备(夹持及加热装置省略):

①实验过程中装置丙中可能发生反应的离子方程式有____________。
②该装置气密性检查方法及操作:_________________________。
(2)氯化铁的性质探究:
为探究氯化铁的性质设计了如下实验。(查阅文献知:①氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2 ②FeCl2熔点670℃)
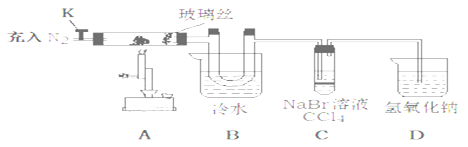
操作步骤 | 实验现象 | 解释原因 |
打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因___________。 |
关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因__________________________。 |
实验结束,振荡C静置 | ③_____________ | ④________________________。(用方程式解释) |
【答案】OH-+ H+= H2O、C12+2OH-= ClO-+ Cl-+ H2O关闭两个分液漏斗活塞及弹簧夹2,打开弹簧夹1、3,丙烧杯中盛蒸馏水,将导气管插入烧杯中水中,用酒精灯微热甲装置中的烧瓶,若导管末端产生气泡,停止微热,有水柱形成,说明装置不漏气排出装置内的空气FeCl3易升华溶液分层,上层接近无色,下层为橙红色2FeCl3![]() 2FeCl2+Cl2;2Br-+Cl2=Br2+2Cl-
2FeCl2+Cl2;2Br-+Cl2=Br2+2Cl-
【解析】
(1)①根据装置图,装置甲中二氧化锰与浓盐酸反应生成氯气;装置乙中盐酸与铁反应生成氢气,氢气和氯气反应生成氯化氢和装置甲和乙中挥发出来的氯化氢在丙中与氢氧化钠反应,过量的氯气在丙中与氢氧化钠反应除去;装置丙中可能发生反应的离子方程式有OH-+ H+= H2O、C12+2OH-= ClO-+ Cl-+ H2O,故答案为:OH-+ H+= H2O、C12+2OH-= ClO-+ Cl-+ H2O;
②该装置气密性检查方法及操作为关闭两个分液漏斗活塞及弹簧夹2,打开弹簧夹1、3,丙烧杯中盛蒸馏水,将导气管插入烧杯中水中,用酒精灯微热甲装置中的烧瓶,若导管末端产生气泡,停止微热,有水柱形成,说明装置不漏气,故答案为:关闭两个分液漏斗活塞及弹簧夹2,打开弹簧夹1、3,丙烧杯中盛蒸馏水,将导气管插入烧杯中水中,用酒精灯微热甲装置中的烧瓶,若导管末端产生气泡,停止微热,有水柱形成,说明装置不漏气;
(2)①为防止空气对实验的干扰,打开K,充入氮气,故答案为:排出装置内的空气;
②FeC13易升华,B中出现棕黄色固体,故答案为:FeC13易升华;
③充入氮气,关闭K,加热至600℃,充分灼烧固体,2FeC13![]() 2FeCl2+Cl2,
2FeCl2+Cl2,
生成的氯气通入C装置,2Br-+Cl2=Br2+2Cl-,四氯化碳密度比水重,萃取溴单质,使C中溶液分层,上层接近无色,下层橙红色,故答案为:溶液分层,上层接近无色,下层橙红色;
④灼烧固体,2FeC13![]() 2FeCl2+Cl2,生成的氯气在C装置中与溴化钠发生置换,2Br-+Cl2=Br2+2Cl-;故答案为:2FeC13
2FeCl2+Cl2,生成的氯气在C装置中与溴化钠发生置换,2Br-+Cl2=Br2+2Cl-;故答案为:2FeC13![]() 2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-。
2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用如图实验装置进行相应实验,装置正确且能达到实验目的是( )

A. 用图a所示装置干燥SO2气体
B. 用图b所示装置蒸发氯化钠溶液得氯化钠晶体
C. 用图c所示装置分离有机层与水层,水层从分液漏斗下口放出
D. 用图d所示装置测量氨气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙酸性质的叙述错误的是
A. 乙酸是有强烈刺激性气味的无色液体,易溶于水和乙醇
B. 冰醋酸是纯净物
C. 乙酸的酸性比碳酸强,它是一元酸,能与碳酸盐反应
D. 发生酯化反应时,乙酸羧基中的氢原子跟醇中的羟基结合成水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有 NOx、![]() (PAN)、HCOOH、等二次污染物。
(PAN)、HCOOH、等二次污染物。
① 1mol PAN中含有的σ键数目为_______。PAN中C、N、O种元素的第一电离能由大到小的顺序为_________________。
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为________,中心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是__________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图(甲)所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。

(4)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图(乙)所示。已知晶胞参数a=333.7pm,阿伏加德罗常数的值取6.02×1023,则重冰的密度为_______g.cm-3(计算结果精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与金属钠反应产生H2的速率排序正确的是 ①C2H5OH ②H2O ③CH3COOH
A. ①>②>③ B. ②>①>③ C. ③>②>① D. ③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系是2v逆(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-===2Mn2++10CO2↑+8H2O
B. Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C. 惰性电极电解MgCl2溶液:2Cl+2H2O![]() Cl2↑+2OH-+ H2↑
Cl2↑+2OH-+ H2↑
D. 向NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH- ===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
B. 放电时电池内部Li+向负极移动
C. 充电过程中,电池正极材料的质量增加
D. 可加入硫酸以提高电解质的导电性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com