
【题目】研究物质性质的基本程序是一个系统化的过程,其主干可分为四个步骤.下列是研究物质性质的一般程序的第一步是
A. 预测物质性质 B. 观察物质的外观性质
C. 进行实验和观察 D. 做出有关的解释和结论
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室需要 0.1mol/L的 H2SO4溶液980mL,欲用 98%、密度为1.84g/cm3的浓硫酸配制.
(1)所需的主要仪器除量筒、烧杯、玻璃棒外,还需要___________、______________。
(2)其实验操作步骤可分为以下几步:
A.用量筒量取_______mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):_____________________
( D )→( A )→( C )→( )→( )→( )→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须_________________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视量筒刻度线,会导致所配溶液浓度会_________;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛仰视刻度线,所配溶液浓度会____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1: 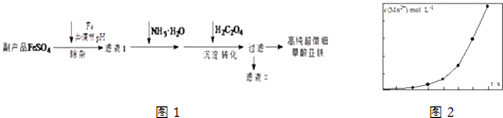
已知:①5Fe2++MnO ![]() +8H+═5Fe3++Mn2++4H2O
+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO ![]() +16H+═10CO2↑+2Mn2++8H2O
+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有
(2)滤液Ⅱ经处理可得到副产品 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2molL﹣1的H2SO4溶解.
步骤2:用0.2000molL﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2molL﹣1的H2SO4溶液,将Fe3+还原为Fe2+ .
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证Cl2、Br2的氧化性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图,填写图中的空白. 
(1)2mL 试剂;加入少量试剂;再加入 试剂; 现象: .
(2)可以证明Cl2的氧化性(填“强于”或“弱于”)Br2的氧化性;氯元素的非金属性(填“强于”或“弱于”)溴元素的非金属性.
(3)此反应的离子方程式为: .
(4)某溶液中Cl﹣、Br﹣、I﹣的物质的量之比为4:1:4,要使溶液中的Cl﹣、Br﹣、I﹣的物质的量之比变为7:1:1,则通入Cl2的物质的量与原溶液中I﹣的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能使H2OH++OHˉ电离平衡向正反应方向移动,而且所得溶液显酸性的是( )
A.将水加热到99℃,使水的pH=6.1
B.在水中滴入稀H2SO4
C.在水中加入Na2CO3固体
D.在水中加入氯化铝固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数为98℅、密度为1.84g/mL的浓硫酸来配制480mL 0.2mol/L 的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。完成下列问题:
(1)上述仪器中,在配制稀硫酸时不需要用到的是___________(填序号)
(2)配制过程中需选用的容量瓶规格为___________ mL,经过计算,需要浓硫酸的体积为_______。
(3)在配制过程中,下列操作错误的是____________,能使所配溶液浓度偏高的是___________(填序号)
①洗涤量取浓硫酸后的量筒,并将洗涤液转移至容量瓶中
②为防止变质,稀释后的硫酸溶液应立即就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④移液前,容量瓶中含有少量蒸馏水
⑤量取浓硫酸时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】〔化学﹣﹣选修2:化学与技术〕 锌锰电池(俗称干电池)在生活中的用量很大.两种锌锰电池的构造如图(a)所示.回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2═Zn(NH3)2Cl2+2MnOOH ①该电池中,负极材料主要是 , 电解质的主要成分是 , 正极发生的主要反应是 .
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是 .
(2)图(b)表示回收利用废旧普通锌锰电池工艺(不考虑废旧电池中实际存在的少量其他金属). 
①图(b)中产物的化学式分别为A , B .
②操作a中得到熔块的主要成分是K2MnO4 . 操作b中,绿色的K2MnO4溶液反应生成紫色溶液和一种黑褐色固体,该反应的离子方程式为 .
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol·L-1 NaOH溶液480 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度 ________(填“>”、“<”或“=”)0.3 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“ >”、“<”或“=”)0.3 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm- 3的浓硫酸的体积为 ________ mL (计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com