
【题目】现用质量分数为98℅、密度为1.84g/mL的浓硫酸来配制480mL 0.2mol/L 的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。完成下列问题:
(1)上述仪器中,在配制稀硫酸时不需要用到的是___________(填序号)
(2)配制过程中需选用的容量瓶规格为___________ mL,经过计算,需要浓硫酸的体积为_______。
(3)在配制过程中,下列操作错误的是____________,能使所配溶液浓度偏高的是___________(填序号)
①洗涤量取浓硫酸后的量筒,并将洗涤液转移至容量瓶中
②为防止变质,稀释后的硫酸溶液应立即就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④移液前,容量瓶中含有少量蒸馏水
⑤量取浓硫酸时,俯视刻度线
【答案】 ②⑦⑧ 500 5.4mL ①②③⑤ ①②
【解析】本题主要考查一定物质的量浓度溶液的配制方法。
(1)上述仪器中,在配制稀硫酸时不需要用到的是②⑦⑧。
(2)配制过程中需选用的容量瓶规格为500mL。c浓=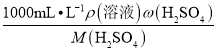 =
=![]() =18.4mol/L。c浓V浓= c稀V稀,V浓=c稀V稀/c浓= 500×0.2/18.4mL=5.4mL,需要浓硫酸的体积为5.4mL。
=18.4mol/L。c浓V浓= c稀V稀,V浓=c稀V稀/c浓= 500×0.2/18.4mL=5.4mL,需要浓硫酸的体积为5.4mL。
(3)在配制过程中,下列操作错误的是①②③⑤,能使所配溶液浓度偏高的是①②。
①所配溶液溶质增多,使所配溶液浓度偏高;
②冷却后溶液体积减小,使所配溶液浓度偏高;
③不可将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水;
④不影响所配溶液浓度;
⑤浓硫酸减少,使所配溶液浓度偏低。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】在甲、乙、丙、丁四个烧杯里分别放入0.1mol的钠,氧化钠,过氧化钠和氢氧化钠,然后各加入100mL水,使固体完全溶解,则甲、乙、丙、丁的溶液中溶质的质量分数大小的顺序为( )
A.甲>乙>丙>丁
B.丁<甲<乙=丙
C.甲=丁<乙=丙
D.丁<甲<乙<丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:

请回答下列问题:
(l)写出实验流程中下列物质的化学式:试剂X_______,沉淀A_______。
(2)上述实验流程中加入过量的Na2CO3的目的是_______。
(3)按此实验方案得到的溶液3中肯定含有_______(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的_______,之后若要获得固体NaNO3需进行的实验操作是_______(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质性质的基本程序是一个系统化的过程,其主干可分为四个步骤.下列是研究物质性质的一般程序的第一步是
A. 预测物质性质 B. 观察物质的外观性质
C. 进行实验和观察 D. 做出有关的解释和结论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列图象的分析错误的是( )
A. 图可表示对平衡N2(g)+3H2(g)2NH3(g)加压、同时移除部分NH3时的速率变化
图可表示对平衡N2(g)+3H2(g)2NH3(g)加压、同时移除部分NH3时的速率变化
B.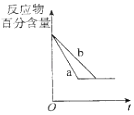 图中a、b曲线只可表示反应H2(g)十I2(g)2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
图中a、b曲线只可表示反应H2(g)十I2(g)2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
C. 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
D. 图表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a<b
图表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应,表达正确的是( )
A. 向KHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:2H+ + SO42-+ Ba2+ + 2OH-= BaSO4↓ + 2H2O
B. CaCO3与醋酸反应:CaCO3 + 2H+=Ca2+ + CO2↑+ H2O
C. 向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HCO3—+2OH— =CaCO3↓+CO32—+2H2O
D. MgSO4溶液跟Ba(OH)2溶液反应:SO42― + Ba2+=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时;向2.0L恒容密闭容器中充入1.0mol PCl5;反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s的平均速率v(PCl3)=0.003 2 molL﹣1s﹣1
B.保持其他条件不变;升高温度;平衡时c(PCl3)=0.11 molL﹣1;则反应的△H<0
C.相同温度下;起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2;反应达到平衡前v(正)>v(逆)
D.相同温度下;起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2;达到平衡时;PCl3的转化率小于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com