
【题目】(I)下表是25℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是(填“>”、“<”或“=”):CH3COOK_____NaClO,两溶液中:[c(Na+)-c(ClO-)]_____[c(K+)-c(CH3COO-)]。
(3)碳酸钠溶液中滴加少量氯水的离子方程式为__________。
(II)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

(4)写出阳极的电极反应式_________。
(5)分析产品室可得到H3PO2的原因___________。
【答案】c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) > = 2CO32-+Cl2+H2O═Cl-+ClO-+2HCO3- 2H2O-4e-=O2↑+4H+ 阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2
【解析】
(I)(1)二者恰好完全反应生成KHC2O4,混合溶液呈酸性,说明HC2O4-电离程度大于水解程度,但是其电离和水解程度都较小;
(2)酸的电离平衡常数越大,其对应的酸根离子水解程度越小,则pH相同的钠盐或钾盐,弱离子水解程度越大其盐溶液浓度越小;
两种溶液的pH相等,则两种溶液中c(H+)、c(OH-)分别相等,[c(Na+)-c(ClO-)]=c(OH-)-c(H+)、[c(K+)-c(CH3COO-)]=c(OH-)-c(H+);
(3)酸的电离平衡常数越大,该酸的酸性越强,强酸能和弱酸盐反应生成弱酸,由于酸性:H2CO3>HClO>HCO3-,所以碳酸钠溶液中滴入少量氯水,二者反应生成NaClO、NaCl和NaHCO3;
II.(4)在阳极上水失电子生成氧气和氢离子;
(5)阳极生成氧气和氢离子,氢离子通过阳离子交换膜进入产品室,阴极上生成氢气和氢氧根离子,原料室中阳离子通过交换膜进入阴极室,原料室中阴离子通过交换膜进入产品室。
I.(1)二者恰好完全反应生成KHC2O4,KHC2O4发生电离:KHC2O4=K++HC2O4-,混合溶液呈酸性,说明HC2O4-电离程度大于水解程度,但是其电离和水解程度都较小,水还电离出氢离子,所以c(H+)>c(C2O42-),溶液中氢氧根离子浓度很小,所以存在c(H+)>c(C2O42-)>c(OH-),则溶液中存在c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(2)酸的电离平衡常数越大,其对应的酸根离子水解程度越小,则pH相同的NaClO和CH3COOK,弱离子水解程度越大其盐溶液浓度越小,电离平衡常数:CH3COOH>HClO,水解程度:NaClO>CH3COOK,所以溶液浓度:c(CH3COOK)>c(NaClO);
[c(Na+)-c(ClO-)]=c(OH-)-c(H+)、[c(K+)-c(CH3COO-)]=c(OH-)-c(H+),两种溶液的pH相等,则两种溶液中c(H+)、c(OH-)分别相等,则[c(Na+)-c(ClO-)]=[c(K+)-c(CH3COO-)]=c(OH-)-c(H+);
(3)酸的电离平衡常数越大,酸的酸性越强,强酸能和弱酸盐反应生成弱酸,酸性:H2CO3>HClO>HCO3-,所以二者反应生成NaClO、NaCl和NaHCO3,二者反应的离子方程式为2CO32-+Cl2+H2O═Cl-+ClO-+2HCO3-;
II.(4)阳极上水失电子生成氧气和氢离子,所以阳极的电极反应式为2H2O-4e-=O2↑+4H+;
(5)在阳极H2O失去电子生成O2和H+,H+通过阳离子交换膜进入产品室,阴极上生成H2和OH-,原料室中阳离子通过交换膜进入阴极室,原料室中阴离子H2PO2-通过交换膜进入产品室,H+与H2PO2-反应产生H3PO2。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】高锰酸钾是重要的氧化剂。回答下列问题:
(1)实验室常用高锰酸钾制备氧气。
①该反应的还原产物是___(写化学式),每生成1gO2转移___mol电子。
②高锰酸钾完全分解后,将固体生成物溶于水后过滤,向滤液中通入过量的二氧化碳。充分反应后过滤,得到二氧化锰,将滤液再经过重结晶分离,可得到高锰酸钾和碳酸氢钾。写出上述过程发生反应的化学方程式:___。
(2)实验室常用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液滴定KMnO4溶液,测定KMnO4溶液浓度。步骤如下:
I.将-定量的高锰酸钾加入烧杯中,倒入蒸馏水使其溶解;
II.取ag草酸晶体(H2C2O4·2H2O,摩尔质量126g·mol-1)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗VmLKMnO4溶液。
①高锰酸钾溶液盛放在___(填“酸式”或“碱式”)滴定管中。
②滴定到达终点的现象是___。
③该KMnO4溶液的物质的量浓度为___mol·L-1(用相关字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体中硝酸盐造成的污染已成为突出的环境问题。某课题组研究了去除不同各种水体中NO3-的方法。
(1)用铝粉去除饮用水中NO3-的一种方案如下:
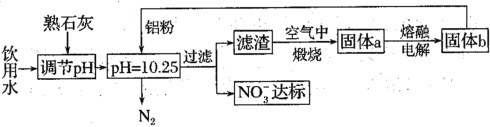
①用熟石灰而不用NaOH调节pH的主要原因是___。在调节pH时,若pH过大或过小都会造成Al的利用率降低。写出pH过大造成Al利用率降低的离子方程式___。
②在加入铝粉去除NO3-的反应中,氧化产物和还原产物的物质的量之比为___。
(2)用铁粉处理pH=2.5的含NO3-废水,测得溶液中相关离子浓度、pH随时间的变化关系如图(部分副反应产物略去):
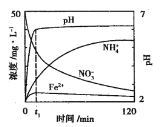
①t1时刻前,该反应的离子方程式为___。
②研究表明:铁粉还原含NO3-废水时,加入活性碳粉可以提高去除NO3-的速率,可能的原因是___。
(3)用Pt作电极电解含NO3-的酸性废水,原理如图。N为电源的___(选填“正”或 “负”)极,与直流电源M端相连的Pt电极上的电极反应式为___。
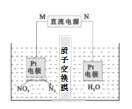
(4)课题组以钛基氧化物涂层材料为惰性阳极、碳纳米管修饰的石墨为阴极,控制一定条件,电解含大量NO3-、SO42-的废水,可使NO3-变为NH4+。研究发现:其他条件不变,废水中加一定量NaCl,去除NH4+的效果明显提高,溶液中氮元素含量显著降低,可能的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水(过氧化氢)常用于消毒、杀菌、漂白等。某化学兴趣小组同学,围绕着过氧化氢开展了调査研究与实验。
I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是________。
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用如图表示,此过程中总反应式为________。

Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
实验编号 | T/X | H2O2初始浓度/mol·L-1 | FeCl3初始浓度/mol·L-1 |
I | 20 | 1.0 | _______ |
II | 50 | 1.0 | 0 |
III | 50 | ___________ | 0.1 |
实验I、Ⅱ研究______对分解速率的影响,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为________mol·L-1。
III.过氧化氢含量的实验测定
兴趣小组同学用0.1000mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2+ +8H2O+5O2↑
(4)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为________mol·L-1(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法正确的是![]()
A.可用25mL碱式滴定管量取![]()
![]() 溶液
溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.用盐酸滴定NaOH溶液时,既可选甲基橙作指示剂又可选酚酞作指示剂
D.用盐酸滴定NaOH溶液时,锥形瓶中有水,误差偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐溶液NaHR的电离方程式为NaHR=Na++HR-下列有关说法不正确的是
A.Na2R溶液的pH值一定大于7
B.若NaHR溶液中c( OH-)>c( R2-)则溶液呈碱性
C.c(Na+)>c(HR-)>c( R2-)>c(OH-)>c( H+)
D.NaHR溶液的pH值不一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是

A. 过程I得到的Li3N中N元素为—3价
B. 过程Ⅱ生成W的反应为Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量的转化形式为化学能转化为电能
D. 过程Ⅲ涉及的反应为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中铋元素的数据如图,下列说法正确的是( )
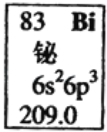
A. Bi元素的质量数是209
B. Bi元素的相对原子质量是209.0
C. Bi原子6p亚层有一个未成对电子
D. Bi原子最外层有5个能量相同的电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com