
【题目】氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法,完成下列问题:

(1)方法一:H2S热分解法,反应式为:H2S (g) ![]() H2 (g)+S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为c mol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
H2 (g)+S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为c mol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
①△H___________0(填“>”“<”或“=”)。
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=______(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:_________________。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I.C(s) + H2O (g) = CO (g) + H2(g) △H = + 131.6 kJ/mol
II.CO (g) + H2O (g) = CO2 (g) + H2 (g) △H = -43 kJ/mol
III.CaO(s) + CO2(g) = CaCO3(s) △H = -178.3 kJ/mol
①计算反应C (s) +2H2O(g) +CaO(s) ==CaCO3 (s)+2H2 (g)的△H=_____(保留到小数点后面1位);若K1、K2、K3分别为反应I、II、III的平衡常数,该反应的平衡常数k=______(用K1、K2、K3表示)。
②对于可逆反应C (s) +2H2O(g) +CaO(s) ![]() CaCO3 (s)+2H2 (g),采取以下措施可以提高H2产率的是___。 (填字母编号)
CaCO3 (s)+2H2 (g),采取以下措施可以提高H2产率的是___。 (填字母编号)
A.适当的降低体系的温度 B.使各气体组分浓度均加倍
C.用特殊材料吸收氢气 D.增加CaO的量
③图2为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c( H2O)=2c(H2)= 2c(CO)=2 mol/L,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图。___________________
(3)以N2、H2为电极反应物,以HCl-NH4C1为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:___________________。
【答案】(1) ① > ②0.4/c ③温度升高,反应速率加快,达到平衡所需时间缩短
(2)①-89.7kJ/mol K1·K2·K3 ② AC ③ (3)N2+6e-+8H+= 2NH4+
(3)N2+6e-+8H+= 2NH4+
【解析】(1)①由图象可知,温度升高,转化率增大,则平衡正移,所以正方向为吸热方向,即△H>0,故答案为:>;
②H2S的起始浓度均为c mol·L-1,若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为c mol·L-1×40%=0.4cmol·L-1,
v=△c/t=0.4c/tmol·L-1·min-1;故答案为:0.4c/tmol·L-1·min-1
③随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;故答案为:温度升高,反应速率加快,达到平衡所需时间缩短;
(2)①已知:I:C(s)+H2O(g)═CO(g)+H2(g)△H = + 131.6 kJ/mol K1
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g) △H = -43 kJ/mol K2
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)△H = -178.3 kJ/mol K3
反应I、II、III之和为反应C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g),△H =+ 131.6 kJ/mol -43 kJ/mol -178.3 kJ/mol = -89.7kJ/mol ,则K=K1·K2·K3 ;故答案为: -89.7kJ/mol 、K1·K2·K3 ;
②提高H2产量,则需使平衡正向移动,已知C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),△H=-87.9kJ·mol-1;
CaCO3(s)+2H2(g),△H=-87.9kJ·mol-1;
A.该反应为放热反应,降低体系的温度,平衡正移,则能提高H2产量,故A正确;
B.该反应前后气体体积不变,使各气体组分浓度均加倍,则压强增大,平衡不移动,所以H2产量不变,故B错误;
C.用特殊材料吸收氢气,平衡正移,则能提高H2产量,故C正确;
D.增加CaO的量,对平衡无影响,所以H2产量不变,故D错误;
故答案为:AC;
③反应中H2O的变化量约等于CO的变化量,当起始水的含量为50%,则H2、CO各占25%,则CO的曲线的起点坐标为(0.1,25),平衡时水的含量为70%,则H2、CO各占15%,H2O含量变化与CO含量变化关于含量y=37.5的直线对称,故图中CO的变化曲线示意图为:
(3)以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+;负极是氢气失电子生成氢离子,电极方程式为H2-2e-=2H+。故答案为:N2+6e-+8H+=2NH4+。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】下列关生物体内化合物的叙述,正确的是( )
A. 淀粉、糖原和纤维素水解得到的单体相同
B. 种子从休眠进入萌发状态,结合水/自由水比值上升
C. 人体内的脂肪能贮存能量、调节代谢
D. 无机盐在人体中都以离子状态存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学概念有关的说法正确的是( )
A.Na2O,CaO,Al2O3均为碱性氧化物
B.液溴不导电,所以液溴是非电解质
C.12C与13C的核外电子排布方式相同,化学性质相同
D.只含共价键的物质一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
A.Na+、Ba2+、Cl、SO42- B. Ca2+、HCO3、C1、K+
C.MnO4、K+、I、H+ D. H+ 、Cl 、Na+ 、CO32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O
B.稀盐酸与氢氧化钡溶液反应:H++OH-=H2O
C.硫酸镁溶液与氢氧化钡溶液反应:SO42-+Ba2+==BaSO4↓
D.稀硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人口资源环境委员会副主任、中国科学院院士秦大河表示,当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因。煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一。
⑴已知:H2O(g)=H2O(I) △H=-44kJ/mol
物质 | H2(g) | C(s) | CO(g) |
燃烧热kJ/mol | -285.8 | -393.5 | -283.0 |
①请写出煤的气化反应生成合成气(CO和H2)的热化学方程式___________。
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是_______。
a.混合气体平均相对分子质量不再改变
b.气体压强不再改变
c.各气体浓度相等
d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氢键速率的2倍
f.混合气体密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
⑵在催化剂作用下合成气合成甲烷过程中会发生如下反应:
I CO(g)+3H2(g) = CH4(g)+H2O(g) △H1= -206 kJ/mol
II CO(g)+H2O(g) = CO2(g)+H2(g) △H2= -41 kJ/mol
Ⅲ 2CO(g)+2H2(g)= CH4(g)+CO2(g) △H 3= -247.4 kJ/mol
①图1是太原理工大学煤化工研究所利用热力学数据分析得到温度对反应ⅠInK(化学平衡常数K的自然对数)的曲线图,请分析出现这样趋势的原因是____________。
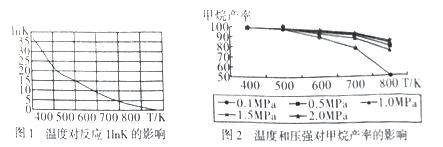
②提高甲烷反应选择性的关键因素是_______,根据相关知识和图2分析合成甲烷适宜的反应条件是
在550~630K,1MPa的原因是__________________。
③850℃时在体积为5L反应器中发生反应Ⅱ,CO和H2O(g)浓度变化如图所示,请列式计算此条件下的平衡常数_____________ 。
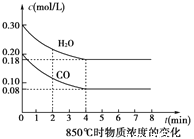
(3)CH4燃料电池利用率很高,装置中添加1L2mol/L的KOH溶液为电解质,持续缓慢通入标准状况下甲烷22.4L~33.6 L时负极电极反应为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,反应后Fe有剩余,则容器中其它存在的单质或离子只能是( )
A.Cu、Fe3+
B.Fe2+、Fe3+
C.Cu、Cu2+
D.Cu、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制硝基苯的主要步骤如下
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50~60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后再用蒸馏水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
请回答下列问题:
(1)配制一定比例浓硫酸与浓硝酸混合酸时,操作注意事项是___________。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是____________。
(3)步骤④中洗涤粗硝基苯使用的仪器是_____________。
(4)步骤④中粗产品用5%的NaOH溶液洗涤的目的是__________________。
(5)写出制硝基苯的方程式________。纯硝基苯是无色、密度比水_____(填“小”或“大”),具有________气味的油状液体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com