
【题目】下列关生物体内化合物的叙述,正确的是( )
A. 淀粉、糖原和纤维素水解得到的单体相同
B. 种子从休眠进入萌发状态,结合水/自由水比值上升
C. 人体内的脂肪能贮存能量、调节代谢
D. 无机盐在人体中都以离子状态存在
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(2016课标Ⅰ)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
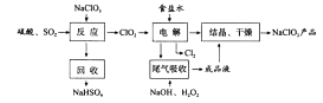
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞中元素和化合物的叙述,正确的是
A. 蛋白质和核酸都主要在细胞核中合成
B. 除核糖体和中心体外,其他各种细胞器均含磷脂成分
C. 内质网和高尔基体的各种成分的含量相同
D. 能源物质都是糖类,所有的糖类都是能源物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生成乙酸的方法中,最符合绿色化学思想的是
A. 乙酸乙酯水解:CH3COOC2H5+H2O![]() CH3COOH+C2H5OH
CH3COOH+C2H5OH
B. 乙醛氧化:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
C. 淀粉发酵:淀粉→葡萄糖→乙醇→乙酸
D. 丁烷氧化:2CH3CH2CH2CH3+5O2![]() 4CH3COOH+2H2O
4CH3COOH+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中共存的是( )
A.K+、H+、SO42﹣、OH﹣
B.Na+、Ca2+、CO32﹣、NO3﹣
C.Na+、H+、Cl﹣、CO32﹣
D.Na+、Cu2+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞中化合物的叙述中,不正确的是
A. 淀粉、脂肪、蛋白质和DNA、RNA都是大分子物质
B. 脂肪、肝糖原、肌糖原、淀粉均为细胞内储存能量的物质
C. 构成细胞的任何一种化学元素都能在无机自然界找到
D. 蛋白质是含量最多的有机物,是生命活动的主要承担者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的酒精溶液 ③碘的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.分液、蒸馏、萃取
C.萃取、蒸馏、分液
D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法,完成下列问题:

(1)方法一:H2S热分解法,反应式为:H2S (g) ![]() H2 (g)+S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为c mol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
H2 (g)+S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为c mol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
①△H___________0(填“>”“<”或“=”)。
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=______(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:_________________。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I.C(s) + H2O (g) = CO (g) + H2(g) △H = + 131.6 kJ/mol
II.CO (g) + H2O (g) = CO2 (g) + H2 (g) △H = -43 kJ/mol
III.CaO(s) + CO2(g) = CaCO3(s) △H = -178.3 kJ/mol
①计算反应C (s) +2H2O(g) +CaO(s) ==CaCO3 (s)+2H2 (g)的△H=_____(保留到小数点后面1位);若K1、K2、K3分别为反应I、II、III的平衡常数,该反应的平衡常数k=______(用K1、K2、K3表示)。
②对于可逆反应C (s) +2H2O(g) +CaO(s) ![]() CaCO3 (s)+2H2 (g),采取以下措施可以提高H2产率的是___。 (填字母编号)
CaCO3 (s)+2H2 (g),采取以下措施可以提高H2产率的是___。 (填字母编号)
A.适当的降低体系的温度 B.使各气体组分浓度均加倍
C.用特殊材料吸收氢气 D.增加CaO的量
③图2为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c( H2O)=2c(H2)= 2c(CO)=2 mol/L,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图。___________________
(3)以N2、H2为电极反应物,以HCl-NH4C1为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com