
【题目】(2016课标Ⅰ)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
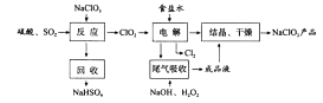
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
【答案】(1)+3;(2)2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4;
(3)NaOH溶液 ;Na2CO3溶液 ;ClO2(或NaClO2);
(4)2:1; O2;
(5)1.57。
【解析】(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3。(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,根据得失电子守恒和原子守恒,此反应的化学方程式为2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。(3)食盐溶液中混有Mg2+和Ca2+,可利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+;向NaCl溶液中加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2, 阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;(4)根据图示可知:利用含有过氧化氢的NaOH溶液吸收ClO2气体,产物为NaClO2,则此吸收反应中,氧化剂为ClO2,还原产物为NaClO2,还原剂是H2O2,氧化产物是O2,每1 mol的H2O2转移2 mol电子,反应方程式是:2NaOH+2ClO2+H2O2=2NaClO2+O2+2H2O,可知氧化剂和还原剂的物质的量之比为2:1,该反应中氧化产物为O2。(5)每克NaClO2的物质的量n(NaClO2)=1g÷90.5 g/mol=![]() mol,其获得电子的物质的量是n(e)=
mol,其获得电子的物质的量是n(e)=![]() mol×4=4/90.5 mol,1 mol Cl2获得电子的物质的量是2 mol,根据电子转移数目相等,可知其相对于氯气的物质的量为n=
mol×4=4/90.5 mol,1 mol Cl2获得电子的物质的量是2 mol,根据电子转移数目相等,可知其相对于氯气的物质的量为n=![]() mol×4÷2=
mol×4÷2=![]() mol,则氯气的质量为
mol,则氯气的质量为![]() mol× 71 g/mol=1.57 g。
mol× 71 g/mol=1.57 g。


科目:高中化学 来源: 题型:
【题目】一学生用如图装置研究原电池原理,下列说法错误的是:

A. (3)图中Zn片增重质量与Cu棒减轻质量的比值为65:64
B. (2)图中如果两极上都有气体产生,则说明Zn片不纯
C. (1)图中铜棒上没有气体产生
D. (2)图与(3)图中正极生成物质质量比为1:32时,Zn棒减轻的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:

(1)在实验室中由粗盐“重结晶”的操作包括溶解、过滤、蒸发、_________(填操作方法)、洗涤等步骤;有关其中“蒸发”步骤的叙述错误的是____________。
a. 蒸发的目的是得到热饱和溶液 b. 蒸发的目的是析出晶体
c. 应用余热蒸干溶液 d. 应蒸发至有较多晶体析出时为止
(2)由MgCl2溶液得到MgCl2·6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是_________。

a. 得到热饱和溶液 b. 析出晶体
(3)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:__________。
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是_____________________________________。
(5)MgCl2可电解制Mg,MgO则是重要的耐火材料。在550℃时,MgCl2·6H2O会分解生成MgO、MgCl2、HCl和H2O,若不补充其它原料,使一定量的MgCl2·6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则a∶b为______________(取整数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6 molH2和3 molCO充入容积为0.5 L的密闭容器中,进行反应:2H2(g) + CO(g)![]() CH3OH(g),6 s时反应达到平衡,此时容器内压强为开始时的0.6倍,则H2的平均反应速率为________________,CO的转化率为____________________。
CH3OH(g),6 s时反应达到平衡,此时容器内压强为开始时的0.6倍,则H2的平均反应速率为________________,CO的转化率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z的最外层电子数之比为 2:3,常见化合物Y2X2与水反应生成X的单质,其水溶液可使酚酞试液变红。请回答下列问题:
(1)Z的原子结构示意图为___________________________;
(2)化合物Y2X2中含有的化学键类型有____________(填序号)。
A.离子键 B.极性共价键 C.非极性键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为: ______________________________________________。
(4)将Z与X形成的气态化合物ZX2通入Ba(NO3)2溶液中,有白色沉淀和一氧化氮气体生成,发生反应的离子方程式为:___________________________________________。
(5)由BA4、X2、YXA溶液可以组成原电池,则组成该原电池的负极反应式为:_____________________,
原电池工作一段时间后,整个溶液的pH将__________(填“增大”、“不变”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 提取溴水中的溴单质的方法:加入酒精后,振荡、静置、分液
B. 除去CO2气体中混有的SO2的方法:通过装有饱和碳酸氢钠溶液的洗气瓶
C. 向铜和浓硫酸反应后的混合液中加水,可以判断有无铜离子生成
D. 金属钠着火可以二氧化碳气体来灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关生物体内化合物的叙述,正确的是( )
A. 淀粉、糖原和纤维素水解得到的单体相同
B. 种子从休眠进入萌发状态,结合水/自由水比值上升
C. 人体内的脂肪能贮存能量、调节代谢
D. 无机盐在人体中都以离子状态存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学概念有关的说法正确的是( )
A.Na2O,CaO,Al2O3均为碱性氧化物
B.液溴不导电,所以液溴是非电解质
C.12C与13C的核外电子排布方式相同,化学性质相同
D.只含共价键的物质一定是共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com