
【题目】A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z的最外层电子数之比为 2:3,常见化合物Y2X2与水反应生成X的单质,其水溶液可使酚酞试液变红。请回答下列问题:
(1)Z的原子结构示意图为___________________________;
(2)化合物Y2X2中含有的化学键类型有____________(填序号)。
A.离子键 B.极性共价键 C.非极性键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为: ______________________________________________。
(4)将Z与X形成的气态化合物ZX2通入Ba(NO3)2溶液中,有白色沉淀和一氧化氮气体生成,发生反应的离子方程式为:___________________________________________。
(5)由BA4、X2、YXA溶液可以组成原电池,则组成该原电池的负极反应式为:_____________________,
原电池工作一段时间后,整个溶液的pH将__________(填“增大”、“不变”或“减小”)
【答案】 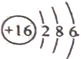 AC H2O2+H2S=S↓+ 2H2O 3SO2+3Ba2++2NO3-+2H2O=3BaSO4+2NO+4H+ CH4-8e-+10OH-=CO32-+ 7H2O 减小
AC H2O2+H2S=S↓+ 2H2O 3SO2+3Ba2++2NO3-+2H2O=3BaSO4+2NO+4H+ CH4-8e-+10OH-=CO32-+ 7H2O 减小
【解析】A与B和A与X均可形成10个电子化合物,则A应为H元素,A与Y同主族,则Y为Na元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则X为O元素,Y2X2为Na2O2,X与Z同主族,则Z为S元素,B与Z的最外层电子数之比为2:3,则B元素的最外层电子数为4,根据A、B、X、Y和Z是原子序数依次递增的短周期元素,B应为C元素,则
(1)Z为S元素,核电核数为16,原子核外有3个电子层,最外层电子数为6,则原子结构示意图为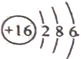 ;(2)Y2X2为Na2O2,为离子化合物,化合物中含有离子键,氧原子之间为非极性共价键,答案选AC;(3)A与X,A与Z均能形成18个电子的极性分子化合物,其化合物分子式分别为H2O2、H2S,二者反应的方程式为H2O2+H2S=S↓+ 2H2O;(4)在酸性溶液中硝酸根具有氧化性,能把SO2氧化为硫酸,进而生成硫酸钡沉淀,硝酸根被还原为NO,发生反应的离子方程式为3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO+4H+。(5)原电池负极发生失去电子的氧化反应,则甲烷应该在负极通入,由于电解质溶液显碱性,则组成该原电池的负极反应式为CH4-8e-+10OH-=CO32-+ 7H2O;原电池工作一段时间后消耗氢氧根离子,因此整个溶液的pH将减小。
;(2)Y2X2为Na2O2,为离子化合物,化合物中含有离子键,氧原子之间为非极性共价键,答案选AC;(3)A与X,A与Z均能形成18个电子的极性分子化合物,其化合物分子式分别为H2O2、H2S,二者反应的方程式为H2O2+H2S=S↓+ 2H2O;(4)在酸性溶液中硝酸根具有氧化性,能把SO2氧化为硫酸,进而生成硫酸钡沉淀,硝酸根被还原为NO,发生反应的离子方程式为3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO+4H+。(5)原电池负极发生失去电子的氧化反应,则甲烷应该在负极通入,由于电解质溶液显碱性,则组成该原电池的负极反应式为CH4-8e-+10OH-=CO32-+ 7H2O;原电池工作一段时间后消耗氢氧根离子,因此整个溶液的pH将减小。


科目:高中化学 来源: 题型:
【题目】将氯化铜、氯化铝、氯化亚铁、氯化铁、氯化镁五种无色溶液,通过一种试剂就能鉴别,这种试剂是( )
A.KSCN
B.BaCl2
C.HCl
D.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合碱式碳酸镁[4MgC03·Mg(OH)2·4H2O〕,又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90% ,碳酸钙10%〕碳化法制取:
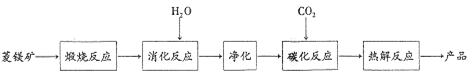
(1)根据下列表格数据,选择消化反应的最佳温度_____;理由是__________。

(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为_______。
(3)流程图中______和_____可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5时,可以认为完全除去。常温时当调节溶液pH为9.5时,此时Mn2+小于_____mol/L,不会沉淀出来。

②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为______。
A. Ca(C10)2 B. Cl2 C. H202 D. HNO3
③下列方案中,较好的为_______,理由是___________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应 aA(g) ![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
A.A的转化率变小 B.平衡向正反应方向移动
C.D的物质的量变多 D.a>c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016课标Ⅰ)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
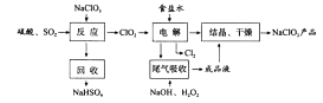
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞中元素和化合物的叙述,正确的是
A. 蛋白质和核酸都主要在细胞核中合成
B. 除核糖体和中心体外,其他各种细胞器均含磷脂成分
C. 内质网和高尔基体的各种成分的含量相同
D. 能源物质都是糖类,所有的糖类都是能源物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中共存的是( )
A.K+、H+、SO42﹣、OH﹣
B.Na+、Ca2+、CO32﹣、NO3﹣
C.Na+、H+、Cl﹣、CO32﹣
D.Na+、Cu2+、Cl﹣、SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com