
【题目】下列物质中属于非电解质的是
A. 氢氧化钠溶液 B. CO2
C. N2 D. 熔融的氯化镁
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是
A. H2SO4=H2++SO42- B. Ba(OH)2=Ba2++OH-
C. NaNO3=Na++NO3- D. HClO=H++Cl-+O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一学生用如图装置研究原电池原理,下列说法错误的是:

A. (3)图中Zn片增重质量与Cu棒减轻质量的比值为65:64
B. (2)图中如果两极上都有气体产生,则说明Zn片不纯
C. (1)图中铜棒上没有气体产生
D. (2)图与(3)图中正极生成物质质量比为1:32时,Zn棒减轻的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,容积为 1L 的密闭容器中发生反应: SiF4(g)+2H2O(g) ![]() SiO2(s)+4HF(g)。下列各项中不能说明该反应已达化学平衡状态的是( )
SiO2(s)+4HF(g)。下列各项中不能说明该反应已达化学平衡状态的是( )
A.v(SiF4)消耗=4v(HF)生成 B.HF 的体积分数不再变化
C.容器内气体压强不再变化 D.容器内气体总质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:
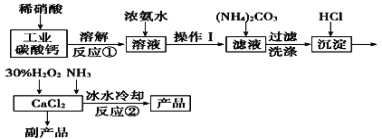
已知:CaO2·8H2O呈白色微溶于水。
(1)写出反应①中氧化还原反应的离子方程式: ______________。
(2)向反应①后的溶液中加浓氨水的目的是: __________________。
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①__________________;②______________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴滴入浓度为c mol·L-1的Na2S2O3标准溶液至反应终点,消耗Na2S2O3溶液V mL。
已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
①滴定终点的现象为____________,产品中CaO2的质量分数为_________________
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________ (填“不受影响”“偏低”或“偏高”),原因是_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐(3PbO·PbSO4·H2O)可用作聚氯乙烯的热稳定剂,200℃以上开始失去结晶水,不溶于水及有机溶剂。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示。

已知:PbSO4和PbCO3的溶解度和溶度积Ksp如下表。

(1)步骤①转化的目的是_______,滤液1中的溶质为Na2CO3和_______(填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是_________(任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为__________________。
(3)滤液2中可循环利用的溶质的化学式为_______。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______mol/L。
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是________________。
(5)步骤⑥合成三盐的化学方程式为____________,若得到纯净干燥的三盐99.Ot,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:

(1)在实验室中由粗盐“重结晶”的操作包括溶解、过滤、蒸发、_________(填操作方法)、洗涤等步骤;有关其中“蒸发”步骤的叙述错误的是____________。
a. 蒸发的目的是得到热饱和溶液 b. 蒸发的目的是析出晶体
c. 应用余热蒸干溶液 d. 应蒸发至有较多晶体析出时为止
(2)由MgCl2溶液得到MgCl2·6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是_________。

a. 得到热饱和溶液 b. 析出晶体
(3)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:__________。
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是_____________________________________。
(5)MgCl2可电解制Mg,MgO则是重要的耐火材料。在550℃时,MgCl2·6H2O会分解生成MgO、MgCl2、HCl和H2O,若不补充其它原料,使一定量的MgCl2·6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则a∶b为______________(取整数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关生物体内化合物的叙述,正确的是( )
A. 淀粉、糖原和纤维素水解得到的单体相同
B. 种子从休眠进入萌发状态,结合水/自由水比值上升
C. 人体内的脂肪能贮存能量、调节代谢
D. 无机盐在人体中都以离子状态存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com