
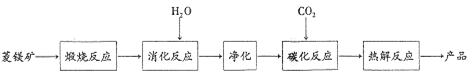
����Ŀ�����Σ�3PbO��PbSO4��H2O��������������ϩ�����ȶ�����200�����Ͽ�ʼʧȥ�ᾧˮ��������ˮ���л��ܼ�����200.0tǦ�ࣨ��Ҫ�ɷ�ΪPbO��Pb��PbSO4�ȣ�Ϊԭ���Ʊ����εĹ���������ͼ��ʾ��

��֪��PbSO4��PbCO3���ܽ�Ⱥ��ܶȻ�Ksp���±���

��1��������ת����Ŀ����_______����Һ1�е�����ΪNa2CO3��_______���ѧʽ����
��2������������ʱ��Ϊ����������ʣ��ɲ�ȡ�Ĵ�ʩ��_________����дһ����������Ǧ�����ᷴӦ����Pb(NO3)2��NO�����ӷ���ʽΪ__________________��
��3����Һ2�п�ѭ�����õ����ʵĻ�ѧʽΪ_______������������Ǧ�����Һ��c(Pb2+)=1.82��10-5mol/L�����ʱc(SO42-)=______mol/L��
��4��������ϴ�Ӳ���ʱ����������Ƿ�ϴ����ȫ�ķ�����________________��
��5���������ϳ����εĻ�ѧ����ʽΪ____________�����õ��������������99.Ot������Ǧ���е�ǦԪ����80��ת��Ϊ���Σ���Ǧ����ǦԪ�ص���������Ϊ________��
���𰸡���1�� ��PbSO4ת��ΪPbCO3�����Ǧ�������� Na2SO4 ��2�� �ʵ����£����ʵ���������Ũ�Ȼ��С�������������������𰸣� 3Pb+8H++2NO3-=3Pb2++2NO��+4H2O HNO3 ��3��1.00��10-3 ��4��ȡ�������һ�ε�ϴ��Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ�������������𰸣� ��5�� 4PbSO4+6NaOH![]() 3Na2SO4+3PbO��H2O+2H2O 51.75%
3Na2SO4+3PbO��H2O+2H2O 51.75%
����������Ǧ���м���Na2CO3��Һ��PbSO4ת��Ϊ����PbCO3�����ӷ���ʽΪCO32-+PbSO4=PbCO3+SO42-��Ȼ����˵õ���Һ1ΪNa2SO4��Һ���������м����������ܣ�PbO��Pb��PbCO3�������ᷴӦ����Pb��NO3��2��Pb�����ᷴӦ������NO��Ǧ����������Pb��NO3��2��NO�����ӷ���ʽΪ3Pb+8H++2NO3-=3Pb+2NO��+4H2O��Ȼ������Һ�м������ᣬ����bSO4���������ˣ���Һ2����Ҫ�ɷ���HNO3���������м���NaOH��Һ��������Ӧ4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O������ϴ�Ӹ���õ�3PbOPbSO4H2O����Һ3�к���Na2SO4��
��1���������ô�����Һ����Ǧ�࣬��PbSO4ת��ΪPbCO3�����Ǧ�������ʣ���Һ1�е�����Ϊ������Na2CO3�ͷ�Ӧ���ɵ�Na2SO4��
��2������������ʱ������ͨ���ʵ����¡��ʵ���������Ũ�Ȼ��С��������������������ʣ�ͨ�����Ϸ���֪�������ӷ�Ӧ����ʽΪ3Pb+8H++2NO3-=3Pb2++2NO��+4H2O��
��3����Һ2�п�ѭ�����õ����ʵĻ�ѧʽΪHNO3 ������Ksp��PbSO4��=1.82��10-8=c(Pb2+)��c(SO42-)��c(Pb2+)=1.82��10-5mol/L�����ʱc(SO42-)=1.00��10-3mol/L��
��4���ó�����������������������ӣ��������ữ���Ȼ������飬����鷽��Ϊȡ�������һ�ε�ϴ�ӹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ��
��5���������ϳ����εĻ�ѧ����ʽΪ4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O�����õ��������������99.0t�����е�ǦԪ������Ϊ99.0t��![]() ��100%=82.8t����Ǧ����ǦԪ�ص���������Ϊ
��100%=82.8t����Ǧ����ǦԪ�ص���������Ϊ![]() =51.75%��
=51.75%��


 ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������ṹ������У���Ԫ����ɲ���ͬ����
A. ��ϸ�����ء��ȵ��ء��������� B. �����塢Ⱦɫ�塢Ŀ�Ļ����������
C. ֬���ᡢ��ͪ�ᡢ������ D. ���塢Ĥ�����塢����ø
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�ͭ���Ȼ������Ȼ��������Ȼ������Ȼ�þ������ɫ��Һ��ͨ��һ���Լ����ܼ��������Լ��ǣ�������
A.KSCN
B.BaCl2
C.HCl
D.NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ת����ϵ�ж�����˵����ȷ����(��Ӧ��������ȥ)

A. ��Ӧ�٢ڢۢܢ�������������Ӧ�����ӷ�Ӧ
B����Ӧ��˵�������������Ļ�ԭ��ǿ����
C����ͬ���������ɵ�����O2����Ӧ������ת�Ƶĵ�����֮��Ϊ1��1
D����Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ1��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ڷǵ���ʵ���
A. ����������Һ B. CO2
C. N2 D. ���ڵ��Ȼ�þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A�������ӵ�������ȷֵӦΪ6.02��1023mol��1
B����״���£�17g���������Ϊ22.4L/mol
C�����³�ѹ�����£�3.6gH2O������ԭ����Ϊ0.4NA
D��Ũ��Ϊ0.1 mol/LNa2CO3��Һ�У�Na+��Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ϼ�ʽ̼��þ[4MgC03��Mg(OH)2��4H2O�����ֳ�����̼��þ����������þ��(��������Ϊ̼��þ90% ��̼���10%��̼������ȡ��
��1���������б������ݣ�ѡ��������Ӧ������¶�_____��������__________��

��2��̼����Ӧ������Mg(HCO3)2������Mg(HCO3)2�Ļ�ѧ����ʽΪ_______��
��3������ͼ��______��_____����Ϊ̼����Ӧ�ṩ������̼Դ��
��4���й����������±ˮ̼������ȡ����̼��þ��
��±ˮ�к���Fe2+��Mn2+������Ũ��С��1��10-5ʱ��������Ϊ��ȫ��ȥ������ʱ��������ҺpHΪ9.5ʱ����ʱMn2+С��_____mol/L���������������

�������Fe2+ת��ΪFe3+���ӻ����Ƕ�ѡ������ʵ�������Ϊ______��
A. Ca(C10)2 B. Cl2 C. H202 D. HNO3
�����з����У��Ϻõ�Ϊ_______��������___________��
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������з������з�Ӧ aA(g) ![]() cC(g)��dD(g)����Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬���ٴδﵽƽ��ʱ��D��Ũ��Ϊԭƽ���1.7��������������ȷ����( )
cC(g)��dD(g)����Ӧ�ﵽƽ����������ѹ����ԭ����һ�룬���ٴδﵽƽ��ʱ��D��Ũ��Ϊԭƽ���1.7��������������ȷ����( )
A��A��ת���ʱ�С B��ƽ��������Ӧ�����ƶ�
C��D�����ʵ������ D��a��c��d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ӣ�������Һ�й�����ǣ�������
A.K+��H+��SO42����OH��
B.Na+��Ca2+��CO32����NO3��
C.Na+��H+��Cl����CO32��
D.Na+��Cu2+��Cl����SO42��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com